10.1002/ejp.2295
ARTÍCULO DE LA REVISTA EJP
Valor pronóstico de la hiperalgesia mecánica preoperatoria y cualidades del dolor neuropático en dolor postoperatorio tras artroplastia total de rodilla
Prognostic value of preoperative mechanical hyperalgesia and neuropathic pain qualities for postoperative pain after total knee replacement
A. D. Vigotsky1,2
O. Cong1,3
C. B. Pinto1,3
J. Barroso4
J. Perez1,3
K. Kjaer Petersen5,6
L. Arendt-Nielsen5,6,7,8
K. D. Hardt9
D. Manning9
A. V. Apkarian1,3,4
P. Branco1,3,4
1Centro de Investigación Traslacional del Dolor, Facultad de Medicina Feinberg de la Universidad Northwestern, Chicago, Illinois, EEUU
2Departamento de Ingeniería Biomédica y Estadística, Universidad Northwestern, Evanston, Illinois, EEUU
3Departamento de Neurociencia, Facultad de Medicina Feinberg de la Universidad Northwestern, Chicago, Illinois, EEUU
4Departamento de Anestesiología, Facultad de Medicina Feinberg de la Universidad Northwestern, Chicago, Illinois, EEUU
5Departamento de Ciencia y Tecnología Sanitarias, Centro de Neuroplasticidad y Dolor (CNAP), SMI, Facultad de Medicina, Universidad de Aalborg, Aalborg, Dinamarca
6Departamento de Materiales y Producción, Centro de Modelización Matemática de la Osteoartritis de Rodilla (MathKOA), Facultad de Ingeniería y Ciencias, Universidad de Aalborg, Aalborg, Dinamarca
7Departamento de Gastroenterología Médica, Mech-Sense, Hospital Universitario de Aalborg, Aalborg, Dinamarca
8Centro de Diabetes Steno, Norte de Dinamarca, Instituto Clínico, Hospital Universitario de Aalborg, Aalborg, Dinamarca
9Departamento de Cirugía Ortopédica, Facultad de Medicina Feinberg de la Universidad Northwestern, Chicago, Illinois, EEUU
RESUMEN
Antecedentes: La artroplastia total de rodilla o remplazo total de rodilla (RTR) es el tratamiento de referencia para el dolor crónico de la osteoartritis en etapa final; sin embargo, muchos pacientes refieren dolor postoperatorio crónico tras el RTR. La búsqueda de predictores preoperatorios del dolor postoperatorio crónico tras el RTR se ha estudiado con resultados contradictorios.
Métodos: Este estudio investiga el valor predictivo de los test sensoriales cuantitativos (QST) y PainDETECT para el dolor postoperatorio a los 3, 6 y 12 meses del RTR. Se evaluaron medidas de QST preoperatorias y postoperatorias (3 y 6 meses) en 77 pacientes con OA de rodilla (KOA) y 41 controles sanos, junto con puntuaciones de dolor neuropático en pacientes (PainDETECT). Los parámetros de QST incluyeron el umbral de dolor a la presión (PPT), el umbral de tolerancia al dolor (PTT), la modulación condicionada del dolor (CPM) y la sumación temporal (TS) mediante algometría de manguito, junto con la hiperalgesia mecánica y la sumación temporal a la estimulación repetida por medio de pinchazo.
Resultados: En comparación con los controles sanos, los pacientes con KOA al inicio del estudio mostraron hiperalgesia a la estimulación con pinchazo en la rodilla medial sometida a RTR, y a la presión del manguito en la pantorrilla. Un menor PTT de la algometría de manguito y la hiperalgesia al pinchazo mecánico se asociaron con la intensidad del dolor preoperatorio de la KOA. Además, la hiperalgesia preoperatoria por pinchazo explicó el 25 % de la variación en la intensidad del dolor 12 meses después del RTR, y las puntuaciones preoperatorias de dolor neuropático también explicaron el 30 % y el 20 % de la variación en el dolor postoperatorio a los 6 y 12 meses, respectivamente. La disminución de la hiperalgesia mecánica por pinchazo desde antes de la intervención hasta 3 meses después del RTR se asoció con un menor dolor postoperatorio a los 12 meses de seguimiento del RTR.
Conclusiones: Nuestros hallazgos sugieren que la hiperalgesia por pinchazo preoperatorio y los síntomas de dolor de tipo neuropático muestran un valor predictivo para el desarrollo de dolor crónico posterior a RTR.
Declaración de importancia: Los hallazgos de este estudio tienen implicaciones significativas para el tratamiento del dolor crónico en pacientes con osteoartritis de rodilla, en particular los que se someten a una artroplastia total de rodilla (RTR). La hiperalgesia mecánica y las características similares al dolor neuropático predicen el dolor postoperatorio un año después del RTR, lo que subraya la importancia de comprender los fenotipos del dolor en la osteoartritis para seleccionar estrategias adecuadas de tratamiento del dolor. La normalización de la hiperalgesia después de la cirugía se correlaciona con mejores resultados a largo plazo, lo que subraya aún más el potencial terapéutico de abordar los mecanismos anormales de procesamiento del dolor antes y después del RTR.
ABSTRACT
Background: Total knee replacement (TKR) is the gold standard treatment for endstage chronic osteoarthritis pain, yet many patients report chronic postoperative pain after TKR. The search for preoperative predictors for chronic postoperative pain following TKR has been studied with inconsistent findings.
Methods: This study investigates the predictive value of quantitative sensory testing (QST) and PainDETECT for postoperative pain 3, 6 and 12 months post-TKR. We assessed preoperative and postoperative (3 and 6 months) QST measures in 77 patients with knee OA (KOA) and 41 healthy controls, along with neuropathic pain scores in patients (PainDETECT). QST parameters included pressure pain pressure threshold (PPT), pain tolerance threshold (PTT), conditioned pain modulation (CPM) and temporal summation (TS) using cuff algometry, alongside mechanical hyperalgesia and temporal summation to repeated pinprick stimulation.
Results: Compared to healthy controls, KOA patients at baseline demonstrated hyperalgesia to pinprick stimulation at the medial knee undergoing TKR, and cuff pressure at the calf. Lower cuff algometry PTT and mechanical pinprick hyperalgesia were associated with preoperative KOA pain intensity. Moreover, preoperative pinprick pain hyperalgesia explained 25 % of variance in pain intensity 12 months post-TKR and preoperative neuropathic pain scores also captured 30 % and 20 % of the variance in postoperative pain at 6 and 12 months respectively. A decrease in mechanical pinprick hyperalgesia from before surgery to 3 months after TKR was associated with lower postoperative pain at the 12 months post-TKR follow-up.
Conclusion: Our findings suggest that preoperative pinprick hyperalgesia and neuropathic-like pain symptoms show predictive value for the development of chronic post-TKR pain.
Significance Statement: This study’s findings hold significant implications for chronic pain management in knee osteoarthritis patients, particularly those undergoing total knee replacement surgery (TKR). Mechanical hyperalgesia and neuropathic pain-like characteristics predict postoperative pain 1 year after TKR, emphasizing the importance of understanding pain phenotypes in OA for selecting appropriate pain management strategies. The normalization of hyperalgesia after surgery correlates with better long-term outcomes, further highlighting the therapeutic potential of addressing abnormal pain processing mechanisms pre- and post-TKR.
Correspondencia: Paulo Branco
paulo.branco@northwestern.edu
Recibido: 21-02-2024
Aceptado: 20-05-2024
INTRODUCCIÓN
La osteoartritis de rodilla (KOA) afecta a más de 240 millones de personas en todo el mundo (1) y provoca dolor musculoesquelético crónico y discapacidad (2). La artroplastia total de rodilla (RTR) es el tratamiento estándar de referencia para la KOA en etapa terminal cuando las terapias no quirúrgicas resultan ineficaces, si bien hasta el 34 % de los pacientes experimentan dolor postoperatorio crónico después del RTR (3,4). Se han realizado esfuerzos para identificar factores de riesgo que puedan predecir los resultados del dolor a largo plazo: las pruebas metanalíticas respaldan el papel del dolor preoperatorio, el dolor generalizado, la catastrofización del dolor y la salud mental como factores de riesgo (5). No obstante, el valor predictivo de las características clínicas y psicológicas por sí solas sigue siendo insuficiente para la toma de decisiones clínicas.
Los test sensoriales cuantitativos (QST) se han estudiado como posibles predictores del éxito del RTR dada su capacidad para cuantificar aspectos relacionados con la fisiopatología del dolor crónico, como la hiperalgesia, la sumación temporal (ST) y la modulación condicionada del dolor (CPM), como indicadores de la sensibilización del aparato nociceptivo (6). Muchos pacientes con KOA presentan anormalidades en los QST (7,8), incluida hiperalgesia por presión generalizada, TS facilitada y CPM alterada (6,9,10). También se ha sugerido que las puntuaciones de QST predicen los resultados de las intervenciones (11).
Una revisión sistemática reciente muestra que el umbral de dolor a la presión (PPT) preoperatorio, la TS y la CPM se asocian con mayor frecuencia al dolor crónico postoperatorio (12). Sin embargo, los resultados son contradictorios y difíciles de interpretar debido a la heterogeneidad de los métodos de QST (12) y posiblemente debido a la existencia de múltiples fenotipos de dolor de la OA (7,13). La presencia de síntomas de dolor neuropático antes de la intervención quirúrgica también ha surgido como posible factor predictivo del dolor postoperatorio tras el RTR (14). El cuestionario PainDETECT (15) se ha utilizado para subdividir a los pacientes con KOA en tres grupos —fenotipos con dolor similar al neuropático, al no neuropático y poco claro— que se ha sugerido que responden de forma diferente a los tratamientos (16), con el subgrupo de dolor neuropático mostrando hiperalgesia por presión generalizada en comparación con los otros grupos (17). Además, las puntuaciones preoperatorias más altas de PainDETECT también se han asociado con el dolor crónico postoperatorio después del RTR (18), por encima de la capacidad predictiva de la TS y la hiperalgesia, lo que plantea interrogantes sobre si la TS y la hiperalgesia aprovechan mecanismos similares.
En resumen, los parámetros de QST y las cualidades similares al dolor neuropático son predictores prometedores de los resultados del RTR, pero se requieren más estudios debido a los hallazgos inconsistentes en las publicaciones. Además, la mayoría de los estudios se centran en un único punto temporal, pasando por alto cómo se normalizan los parámetros preoperatorios tras el RTR y cómo se relaciona esta normalización con los resultados a largo plazo.
Por último, la relación entre los QST y el dolor neuropático merece una mayor exploración. El objetivo del presente estudio es (i) comparar los parámetros de QST entre pacientes con KOA y controles sanos, (ii) determinar si los parámetros de QST y las cualidades neuropáticas del dolor predicen el dolor tras la artroplastia a los 3, 6 y 12 meses de seguimiento y (iii) evaluar si los cambios en los parámetros de QST tras la artroplastia están relacionados con los resultados del dolor a largo plazo.
MÉTODOS
Diseño del estudio y participantes
En este estudio observacional, 77 pacientes (edad media 67,2 años, desviación estándar [DE] = 6,9, 70,1% mujeres) con KOA crónica en espera de cirugía RTR fueron reclutados del Departamento de Cirugía Ortopédica del Northwestern Memorial Hospital entre julio de 2019 y noviembre de 2022. Los pacientes invitados a participar eran mayores de 40 años, cumplían con los criterios del Colegio Americano de Reumatología respecto de la KOA, la padecían durante más de 6 meses, informaron dolor de rodilla la mayoría de los días de la semana durante el último mes, tenían una intensidad del dolor superior a 4/10 en la visita preoperatoria, tenían previsto someterse a un RTR en los 3 meses siguientes al consentimiento, sabían leer y hablar inglés y gozaban de buena salud en general. De los 77 pacientes, 14 se habían sometido previamente a un RTR en la otra rodilla (18,2%). Se reclutó una segunda cohorte de 41 participantes de la misma edad y sexo sin antecedentes de OA u otras afecciones de dolor crónico como grupo de control sano (edad media 65,9 años, [DE] = 7,0, 75,6% mujeres). Los datos demográficos y clínicos figuran en la Tabla 1. El tamaño de las muestras se seleccionó basándose en un análisis de potencia a priori (véase más adelante la sección Análisis estadísticos). Se excluyó a los participantes que (i) presentaban indicios de artritis reumatoide, espondilitis anquilosante u otra artropatía inflamatoria; (ii) padecían fibromialgia; (iii) declaraban haber consumido drogas con fines recreativos o tener antecedentes de abuso de alcohol o drogas; (iv) padecían enfermedades neurológicas crónicas (por ejemplo, Alzheimer y Parkinson) o trastornos psiquiátricos (por ejemplo, esquizofrenia); (v) no eran aptos para la exploración por RM; o (vi) padecían otras enfermedades médicas importantes, como insuficiencia cardiaca congestiva o enfermedad vascular periférica. Otro criterio de exclusión para los controles sanos fue la presencia de dolor agudo o crónico. Este estudio forma parte de un proyecto más amplio dirigido a estudiar los predictores cerebrales, psicofísicos y psicológicos, y las consecuencias del dolor crónico tras el RTR; aunque varios parámetros psicológicos, como la depresión, la ansiedad, la catastrofización y otros, pueden predecir los resultados del RTR, en este manuscrito nos centramos específicamente en la capacidad predictiva de los parámetros psicofísicos de los QST. El estudio fue aprobado por la Junta de Revisión Institucional de la Universidad Northwestern (STU00207973), y todos los participantes firmaron un consentimiento informado por escrito.

Las visitas de referencia con los procedimientos de evaluación inicial se realizaron a las 2 semanas de la intervención quirúrgica de RTR de los pacientes con KOA. En esta primera visita, los pacientes dieron su consentimiento, completaron una serie de cuestionarios psicológicos y clínicos, se sometieron a un escáner cerebral y realizaron una evaluación de QST. Se invitó a los pacientes a volver para una evaluación de seguimiento a los 3 y 6 meses de la cirugía de RTR para evaluar su dolor y repetir todos los procedimientos. Debido a las restricciones pandémicas de COVID-19, no todos los pacientes pudieron volver a las visitas de seguimiento; el número total de sujetos por visita y por análisis se indica siempre que es apropiado, y el resumen completo puede encontrarse en la (Tabla S1). Se contactó con los pacientes a los 12 meses sólo para la evaluación clínica del dolor. Los controles sanos participantes completaron los cuestionarios y las evaluaciones de QST una vez.
Medidas relacionadas con el dolor
Todos los pacientes rellenaron el cuestionario PainDETECT para evaluar la intensidad del dolor y la presencia de características similares al dolor neuropático. En este cuestionario, se pedía a los pacientes con KOA que informaran del dolor medio en las últimas 4 semanas en su rodilla con OA (EVA, 0-10), que era la principal medida de resultado en cada momento (antes del RTR y a los 3, 6 y 12 meses tras el mismo). PainDETECT también pregunta a los pacientes sobre su patrón de dolor, la presencia de dolor irradiado y la frecuencia con la que sienten los síntomas característicos del dolor neuropático, como ardor y punzadas (Freynhagen y cols., 2006). Estos síntomas se cuantifican para obtener una puntuación compuesta del perfil de dolor neuropático. Si los pacientes no completaban PainDETECT en un momento determinado (n = 6, 3 y 3 para 3, 6 y 12 meses después del RTR, respectivamente), en su lugar recogíamos sus puntuaciones de dolor por teléfono.
Test sensoriales cuantitativos
Los QST se realizaron con los participantes sentados en una silla reclinable en una habitación tranquila con temperatura controlada (21 °C), con las piernas extendidas y ligeramente flexionadas para mayor comodidad. En este estudio, se utilizó un estimulador de pinchazo para evaluar la sensibilidad al dolor mecánico y el wind-up ratio (WUR) en la rodilla afectada, así como un dispositivo de algometría de presión de manguito para medir el umbral de dolor a la presión, la tolerancia al dolor, la sumación temporal (TS) y la modulación condicionada del dolor (CPM) en la pantorrilla de la misma pierna. Los controles sanos participantes siguieron los mismos procedimientos de QST, pero eligiendo aleatoriamente la lateralidad de la estimulación.
Medidas de pinchazo de la sensibilidad al dolor mecánico y wind-up
La sensibilidad al dolor mecánico y el WUR se evaluaron en la piel adyacente al compartimento medial de la rodilla afectada (Figura S1) mediante una prueba de pinchazo. Se pidió a los participantes que cerraran los ojos o miraran hacia otro lado durante la estimulación y que valoraran su grado de dolor utilizando una Escala de valoración numérica (NRS, 0-100) de 101 puntos tras estímulos únicos (pinchazo 1) o repetidos (pinchazo 10) utilizando un estimulador de pinchazo de 25,6 g calibrado ponderadamente con una punta de 0,6 mm de diámetro (Universidad de Aalborg, Aalborg). Antes de recopilar datos sobre la rodilla sometida a RTR, se realizó una prueba de ensayo en la rodilla contralateral para garantizar que los participantes comprendían las instrucciones y reducir los efectos de las expectativas. A continuación, se evaluó la sensibilidad al dolor mecánico en la rodilla sometida a RTR. En primer lugar, se aplicó un único estímulo monofilamento a la piel de la rodilla y se registró el dolor correspondiente. Posteriormente, se aplicaron 10 estimulaciones consecutivas con monofilamento a un estímulo por segundo dentro de un área de 1 cm2 de la primera estimulación, y los participantes informaron de la intensidad media del dolor en los 10 estímulos. Tras un breve intervalo de descanso, las evaluaciones con un solo estímulo y 10 estímulos se repitieron una vez más en la misma rodilla. Las puntuaciones de dolor (hiperalgesia mecánica) para un único pinchazo (pinchazo 1) y 10 pinchazos consecutivos (pinchazo 10) se registraron como la media de los dos ensayos respectivos. El pinchazo 1 y el pinchazo 10 se utilizaron para calcular el denominado WUR, que se promedió en los dos ensayos (véase también Métodos estadísticos más adelante).
Algometría de presión de manguito
Para examinar las respuestas dinámicas al dolor, TS y CPM, utilizamos un algómetro de presión de manguito controlado por ordenador (Cortex Technology y Universidad de Aalborg, Dinamarca) con un manguito de 13 cm de ancho en el músculo gastrocnemio de cada pierna. Los procedimientos siguen de cerca publicaciones anteriores (10,18). Para la evaluación de los umbrales de dolor y tolerancia a la presión, el manguito se infló automáticamente mediante un ordenador a una velocidad de 30 kPa/s hasta alcanzar una presión máxima de 100 kPa. Los participantes utilizaron una escala analógica visual (EAV) electrónica para el registro continuo de la intensidad del dolor. Se indicó a los participantes que pulsaran un botón cuando el dolor era intolerable.
La señal de la EAV se muestreó a 10 Hz, y 0 y 10 cm en la escala se definieron como dolor mínimo y máximo, respectivamente.
El valor de la presión cuando el sujeto calificó la sensación de dolor como 1 cm en la EAV se definió como umbral de dolor a la presión (PPT). Cuando el sujeto finalizó el examen utilizando el botón de liberación de presión, el valor de presión se definió como umbral de tolerancia al dolor (PTT).
Para evaluar la TS, se administraron 10 estimulaciones repetidas de la presión de manguito con una duración de 1s y un intervalo de 1s entre estímulos en la pierna afectada, inflando el manguito hasta el PTT registrado durante la evaluación anterior. En el periodo entre estímulos, el manguito se desinfló por completo. Se aplicó presión a la intensidad del PTT para garantizar que los sujetos percibieran la estimulación como dolorosa pero no insoportablemente dolorosa debido al breve tiempo de estimulación. Los sujetos valoraron su sensación de dolor en la EAV electrónica durante el inflado del manguito, sin volver a cero entre estimulaciones sucesivas. La puntuación de la EAV inmediatamente después de cada estímulo se extrajo para el cálculo de la ST. La diferencia entre la media de las tres últimas puntuaciones de la EAV y la media de las tres primeras puntuaciones de la EAV se utilizó para calcular el valor de la TS del manguito. Téngase en cuenta que, aunque el WUR y la TS caracterizan un aumento nociceptivo en respuesta a estímulos repetidos, incluimos ambos, ya que se calcularon con diferentes metodologías (pinchazo y algometría de manguito, respectivamente) y en diferentes ubicaciones (la rótula medial y la pantorrilla, respectivamente).
Para la evaluación de la CPM, el manguito de la pierna contralateral se infló a una presión del 70 % de la intensidad PTT del sujeto y se mantuvo a esta presión constante durante la evaluación. Se indicó a los participantes que ignoraran el estímulo en la rodilla contralateral y que se centraran en calificar su dolor en la EAV electrónica para la presión del manguito en su rodilla con OA. Se volvió a evaluar simultáneamente el PPT de la rodilla con OA. La diferencia entre el PPT durante y antes del dolor condicionado se utilizó para calcular la CPM.
Métodos estadísticos
Se especificaron siete variables QST de interés a partir de las medidas descritas anteriormente, en consonancia con estudios anteriores (12,18,19). De las medidas QST de pinchazo, seleccionamos pinchazo 1, pinchazo 10 y su WUR; de las medidas QST de algometría de manguito, seleccionamos PPT, PTT, CPM y TS. Se modeló el dolor de forma continua (es decir, mediante modelado lineal) para evitar dicotomizar a los pacientes en “dolor crónico” o “recuperado” basándose en criterios arbitrarios (20). Las desviaciones del modelo lineal presentaban un sesgo a la derecha, en parte porque muchos pacientes declararon un dolor relativamente leve (NRS <3/10, véase más adelante) a los 6 y 12 meses de la cirugía. Por lo tanto, todas las puntuaciones de dolor se transformaron logarítmicamente (es decir, dolorlog = log10 (dolor + 1)), lo que produjo desviaciones distribuidas con normalidad. Además, transformamos logarítmicamente el WUR, ya que es un cociente, convirtiéndolo de un constructo multiplicativo a uno aditivo. Por lo tanto, los pinchazos 1 y 10 se transformaron primero en logaritmos mediante la ecuación anterior y luego se diferenciaron (log10 (pinchazo 10 + 1) – log10 (pinchazo 1 + 1)) para calcular el WUR. El término +1 permite calcular el WUR para los pacientes que declararon un dolor nulo en el pinchazo 1. Es cierto que esto no es exactamente WUR, pero produce resultados que son en gran medida monotónicos con el WUR real, a la vez que tiene la ventaja de ser estimable. Calculamos las correlaciones entre los QST y las medidas del cuestionario utilizando la p de Spearman.
Para las comparaciones transversales entre pacientes con KOA y controles sanos, se realizó un análisis de covarianza (ANCOVA) comparando cómo diferían los resultados de los QST entre los grupos. Se añadieron al modelo el sexo y la edad como covariables sin interés; además, se incluyó la raza como covariable sin interés para las comparaciones transversales, ya que se observaron diferencias en la proporción de raza entre los controles sanos y los que padecían KOA (Tabla 1). Se ajustaron los valores p para controlar la tasa de descubrimiento falso (FDR).
Para los análisis predictivos longitudinales, primero sondeamos las variables consideradas anormales en los análisis transversales (es decir, en comparación con los controles sanos) y evaluamos su capacidad predictiva; otras variables se probaron post hoc. Aprovechamos las repetidas evaluaciones del dolor modelando los resultados a lo largo del tiempo mediante ecuaciones de estimación generalizada (EEG), lo que permite estimar los “efectos poblacionales” (véanse los modelos de efectos mixtos) a la vez que se controla eficazmente la covarianza entre las medidas repetidas. Las puntuaciones de dolor al inicio y a los 3, 6 y 12 meses de la intervención se predijeron a partir de los parámetros basales de los QST, controlando la edad y el sexo. Dado que el dolor basal era una variable dependiente en estos modelos, no se ajustó por este motivo. Sin embargo, en los modelos de seguimiento específicos de los momentos postoperatorios, incluimos el dolor basal como factor predictivo y evaluamos su importancia relativa en comparación con otros factores predictivos. Se ajustaron las comparaciones múltiples entre puntos temporales mediante el enfoque t multivariante (es decir, “multivariada en el paquete emmeans en R”), que ajusta los valores p en función de la distribución t multivariante del modelo, teniendo en cuenta así la estructura de covarianza de los datos. Por último, las medidas que mostraron una capacidad predictiva estadísticamente significativa (p ajustada < 0,05) se evaluaron longitudinalmente: cómo cambian o se normalizan después de la cirugía. Para ello, ajustamos un modelo lineal multivariable que predecía el dolor 12 meses después del RTR con el inicio y un cambio en las puntuaciones de QST (es decir, el cambio es 3 meses menos el inicio o 6 meses menos el inicio. Para estos análisis, se ejecutaron dos modelos por separado para 3 y 6 meses debido a la falta de datos, ya que los pacientes a los 3 y 6 meses no se solapan por completo.
Los tamaños de las muestras se eligieron basándose en un análisis de potencia a priori; sin embargo, las cifras reales recogidas se desvían ligeramente de las estimaciones iniciales debido a las restricciones pandémicas de COVID-19. La potencia se calculó utilizando G*Power 3.185 y pwd en el paquete en R. Para el estudio transversal, se estimó que un mínimo de 30 participantes por grupo era suficiente para detectar un efecto de d = 0,8 con una potencia del 80 %. Para los análisis de predicción longitudinal, se calculó inicialmente la potencia para clasificar a los pacientes crónicos frente a los recuperados mediante regresión logística y se estimó la necesidad de recoger 105 pacientes, lo que se traduce en una potencia estadística del 82 % para las variables con cocientes de probabilidad >2. Como las puntuaciones de dolor no se ajustaban a una distribución bimodal (véase más arriba) y a los numerosos problemas descritos anteriormente con la dicotomización de los resultados (21), en su lugar realizamos regresiones lineales que también confieren más potencia estadística (21). Así pues, la potencia de este análisis no se calculó explícitamente a priori; la potencia post hoc puede extrapolarse a partir de los valores p (22). Por último, estimamos la necesidad de recoger 30 sujetos para la comparación intra-sujeto con una potencia del 80 % para los análisis de cambio longitudinal, asumiendo efectos de tamaño medio (r entre medidas repetidas = 0,6 o 36 % de varianza compartida). Inicialmente también planeamos disponer de un conjunto de datos de validación para minimizar los errores de tipo I, pero resultó inviable debido a la dificultad de reclutar pacientes durante las restricciones de COVID-19. Sin perjuicio de la potencia estadística, aquí informamos de todos los resultados e informamos de forma transparente de las medidas de incertidumbre (IC), a partir de las cuales los lectores pueden sacar conclusiones sobre qué efectos podría estimar bien el estudio: si los efectos relevantes y nulos se mantienen dentro de los IC, entonces no se pueden sacar conclusiones sólidas debido a la escasa precisión de la estimación. Los tamaños estandarizados de los efectos también se presentan siempre que es apropiado, utilizando R2 para las regresiones lineales y la d de Cohen para las comparaciones de grupos, es decir, la media de un grupo menos el otro, dividida por la desviación estándar agrupada. Cuando se realizan análisis con datos transformados logarítmicamente, calculamos R2
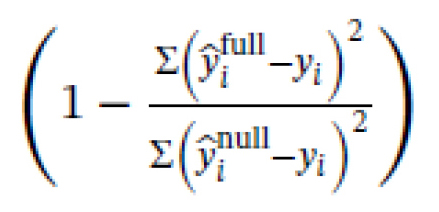
Y ajustamos R2
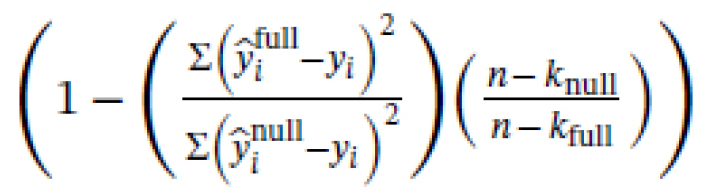
en base a yi e yi transformados de nuevo a sus escalas brutas, donde n es el número de participantes y k es el número de parámetros, incluido el intercepto. Así pues, estos valores R2 tienen en cuenta cualquier sesgo asociado al ajuste de los modelos a la escala logarítmica.
RESULTADOS
Perfiles de QST preoperatorios en pacientes con KOA y en individuos sin dolor
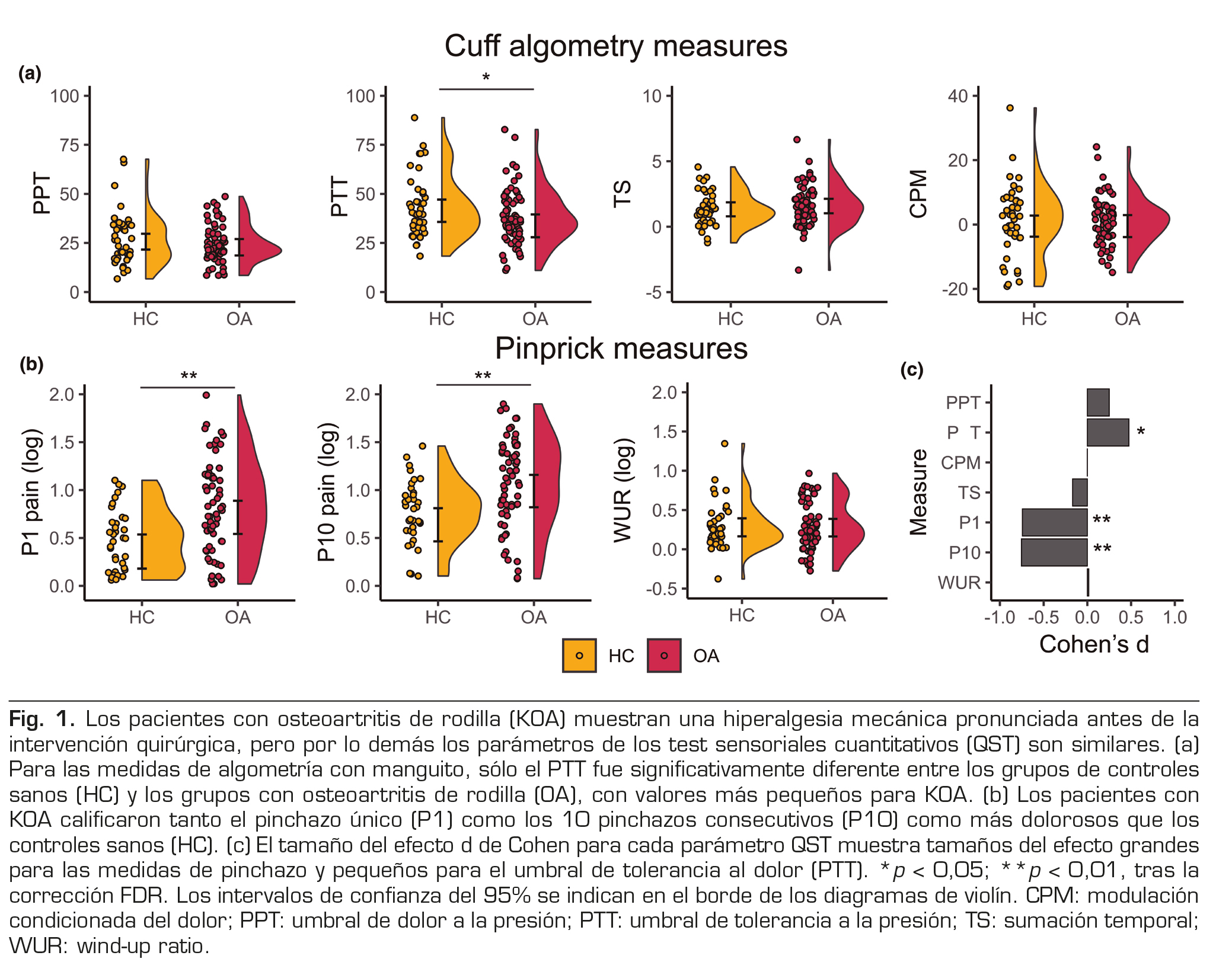
Para las medidas recogidas con el algómetro con manguito, los participantes con KOA mostraron una PTT significativamente inferior en comparación con los controles sanos, aunque esto no superó la corrección FDR (t(104) = -2,25, p = 0,027, pFDR = 0,062, d = 0,47, Figura 1a). Todas las demás medidas de evaluación del manguito no difirieron de forma estadísticamente significativa entre los grupos (todas las p > 0,24, Figura 1a). Para las medidas recogidas con el estimulador mecánico de pinchazo, los pacientes con KOA informaron de un dolor mayor que los controles sanos tanto para el pinchazo único (pinchazo 1, t(94) = 3,35, p = 0,001, pFDR = 0,004, d = 0,74) como para los 10 pinchazos consecutivos (pinchazo 10, t(94) = 3,40, p = 0,001, pFDR = 0,004, d = 0,75). El WUR no mostró diferencias estadísticamente significativas entre los grupos (p = 0,95). En conjunto, nuestros hallazgos sugieren que los pacientes con KOA muestran hiperalgesia mecánica en la rodilla —y un efecto menor de la tolerancia al dolor por presión en la pantorrilla— pero, por lo demás, una sumación temporal y una modulación condicionada del dolor normales en comparación con los individuos sin dolor.
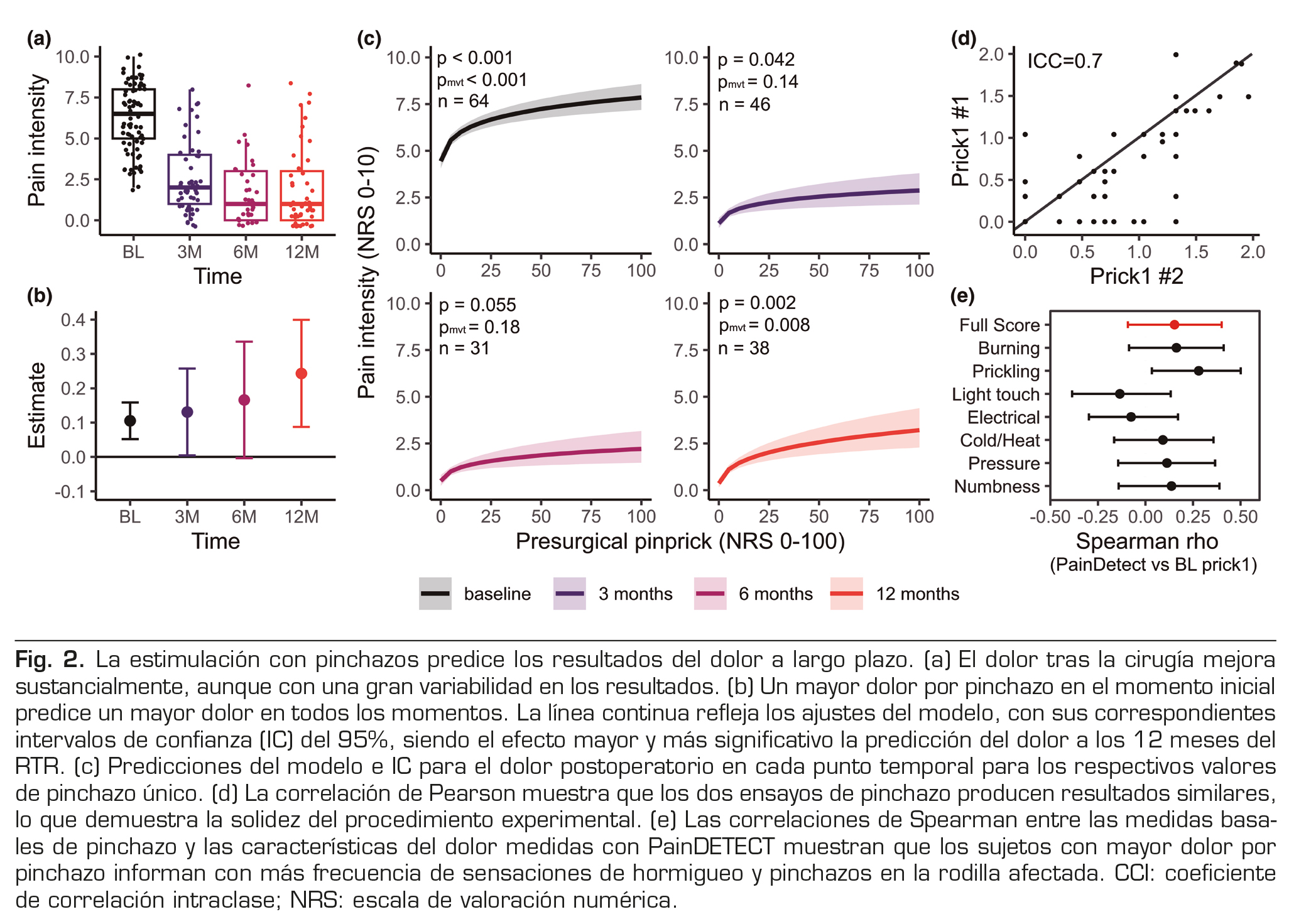
Predicción del dolor tras la artroplastia total de rodilla con QST
De los 77 pacientes incluidos en el estudio, 54 proporcionaron valoraciones del dolor a los 3 meses, 35 a los 6 meses y 46 a los 12 meses, el punto final del estudio.
El dolor de los pacientes mejoró sustancialmente tras la intervención; sin embargo, se observa una variabilidad apreciable en las puntuaciones de dolor entre los sujetos: al inicio del estudio, los pacientes informaron de un dolor medio de 6,3/10 ([DE] = 2,1), 2,5/10 a los 3 meses ([DE] = 2,1), 1,7/10 a los 6 meses ([DE] = 1,9) y 1,9/10 a los 12 meses ([DE] = 2,4), véase la Figura 2a. En primer lugar, se evaluó si las puntuaciones de dolor registradas durante la estimulación con un pinchazo y el TPP —las tres medidas anómalas halladas en el análisis transversal— se asociaban con el dolor antes o a los 3, 6 y 12 meses de la RTC. El dolor registrado con el pinchazo único se asoció con el dolor basal (β = 0,105, p < 0,001, pmvt < 0,001), y predijo el dolor a los 12 meses (β = 0,243, p = 0,002, pmvt = 0,008). Las medidas de pinchazo único se asociaron inicialmente con el dolor a los 3 meses (β = 0,131; p = 0,042) y a los 6 meses de la RTC (β = 0,166; p = 0,055), con intervalos de confianza que apoyaban en gran medida las asociaciones positivas con el dolor (Figura 2b), pero estas asociaciones no siguieron siendo estadísticamente significativas tras ajustar por comparaciones múltiples (3 meses: pmvt = 0,14; 6 meses: pmvt = 0,18). Los ajustes del modelo representan la asociación positiva entre el pinchazo basal y el dolor clínico preoperatorio y puntos posteriores en el tiempo (Figura 2c). La punción basal fue capaz de explicar el 13 % de la varianza en las puntuaciones de dolor al inicio, el 9 % a los 3 meses, el 12 % a los 6 meses y el 25 % a los 12 meses, lo que sugiere que la hiperalgesia mecánica puede explicar una parte significativa de la varianza en el dolor postoperatorio crónico 1 año después del RTR, mucho después de que el tejido se haya curado.
Las puntuaciones de dolor para 10 pinchazos consecutivos también se asociaron significativamente con el dolor basal (β = 0,085, p = 0,004, pmvt = 0,013). Aunque esta medida también predijo el dolor a los 12 meses (β = 0,196, p = 0,026), este resultado no fue estadísticamente significativo tras ajustar por comparaciones múltiples (pmvt = 0,081, los intervalos de confianza y el modelo se pueden inspeccionar en la Figura S1). Las puntuaciones de dolor para los 10 valores de pinchazo consecutivos no fueron estadísticamente significativas predictoras del dolor ni a los 3 meses (β = 0,049, p = 0,479, pmvt = 0,872) ni a los 6 meses después del RTR (β = 0,142, p = 0,075, pmvt = 0,218).
Por último, los valores basales de PTT no se asociaron de forma estadísticamente significativa con el dolor en ningún momento: βs = 0 (IC del 95 %: -0,003, 0,003), 0,001 (IC del 95 %: -0,004, 0,007), 0,002 (IC del 95 %: -0,005, 0,008) y 0,001 (IC del 95%: -0,003, 0,006) al inicio del estudio, a los 3, 6 meses y al año, respectivamente; todos los valores ps > 0,50.
Para completar, también exploramos, post hoc, la capacidad predictiva de las restantes medidas QST. Los WUR, PDT y CPM y no se asociaron de forma estadísticamente significativa con el dolor basal ni fueron capaces de predecir el dolor en puntos temporales futuros (todas las p > 0,42; véanse los Datos S1). La TS evaluada con algometría con manguito se asoció con el dolor basal (β = 0,025, p = 0,021 pmvt = 0,072), aunque este resultado no superó el ajuste para comparaciones múltiples. Además, la ST fue incapaz de predecir el dolor en ninguno de los tres momentos postoperatorios (todos los ps > 0,196).
Propiedades de medición del pinchazo
Se exploraron estos resultados con análisis adicionales. En primer lugar, se evaluó cómo el pinchazo 1 y el pinchazo 10 explican de forma independiente la varianza en los resultados del dolor a los 12 meses. Una correlación de Pearson mostró que estas medidas estaban fuertemente correlacionadas entre sí (r = 0,85, p < 0,001). Cuando ambas medidas se añadieron a un modelo multivariable, el modelo favoreció los valores de pinchazo 1 (β = 0,35 ± 0,17) frente a los valores de pinchazo 10 (β = -0,11 ± 0,19).
Dado que la varianza del pinchazo 1 parece verse favorecida y que las predicciones del pinchazo 10 no sobrevivieron al ajuste para comparaciones múltiples, aquí solo informamos de los resultados de las medidas del pinchazo 1 para análisis posteriores. En segundo lugar, dado que el pinchazo se realizó dos veces (es decir, dos ensayos), evaluamos la fiabilidad de la prueba de las dos puntuaciones por pinchazo. Para ello, se calculó la correlación intraclase (CCI, mixta bidireccional, concordancia absoluta) entre la primera y la segunda prueba, que mostró una buena fiabilidad prueba-repetición con una CCI = 0,70 (Figura 2d). Dado que la expectativa y la ansiedad asociadas al estímulo doloroso pueden contribuir a nuestros resultados, investigamos por separado las capacidades predictivas de la primera y la segunda prueba. Supusimos que la ansiedad y otros efectos influirían más en el primer ensayo que en el segundo. Para cada ensayo, ajustamos un modelo lineal que predecía el dolor a los 12 meses del pinchazo 1 ajustado por edad y sexo. El primer ensayo de pinchazo explicó el 19,7 % de la varianza en los resultados (β = 0,24 ± 0,1, p = 0,015), mientras que el segundo ensayo explicó el 25,1 % de la varianza en los resultados (β = 0,25 ± 0,09, p = 0,010). Por lo tanto, es poco probable que los posibles efectos de la expectativa durante el primer ensayo influyan en nuestros resultados. En tercer lugar, dado que la hiperalgesia mecánica y la alodinia táctil son síntomas característicos del dolor neuropático (23), exploramos las asociaciones entre las puntuaciones basales del pinchazo y la frecuencia y las características de cada sensación dolorosa, según lo medido por el cuestionario PainDETECT, para evaluar si los pacientes con mayor dolor evocado con el pinchazo también informan de otras sensaciones anormales en la rodilla. Para las medidas de pinchazo único, las correlaciones basadas en el rango de Spearman mostraron que las puntuaciones de dolor por pinchazo se correlacionaban significativamente con la frecuencia con la que los pacientes informaban de “sensaciones de pinchazo” en la rodilla osteoartrítica (ρ = 0,28; IC del 95 %: (0,04, 0,50), p = 0,028; Figura 2e). No se encontraron asociaciones significativas adicionales para ninguna otra sensación medida con PainDETECT, incluida la puntuación total (ρ = 0,15, p = 0,24). En el caso del pinchazo 10, volvimos a encontrar asociaciones entre las puntuaciones de pinchazo y el dolor por pinchazo (ρ = 0,27, p = 0,03) y la puntuación PainDETECT completa (ρ = 0,30, p = 0,016). No se hallaron otras asociaciones estadísticamente significativas.
Predicción del dolor tras la artroplastia total de rodilla con características del dolor neuropático
Dados los hallazgos previos que muestran que las características del dolor neuropático predicen los resultados del RTR (18), examinamos además si las puntuaciones neuropáticas basales producidas por PainDETECT también podrían predecir los resultados futuros del dolor.
La distribución de las puntuaciones PainDETECT muestra que los pacientes presentan una variabilidad significativa en las cualidades del dolor neuropático (Figura 3a). Las puntuaciones PainDETECT se asociaron con el dolor basal (β = 0,008, p < 0,001, pmvt <0,001), no se asociaron estadísticamente con el dolor a los 3 meses (β = 0,012, p = 0,052, pmvt = 0,162) pero predijeron significativamente el dolor a los 6 y 12 meses tras el RTR (β = 0,024, p < 0,001, pmvt = 0,002 y β = 0,021, p = 0,004, pmvt = 0,014, respectivamente; véanse la Figura 3b para los intervalos de confianza y la Figura 3c para las predicciones del modelo). En todos los puntos temporales, las puntuaciones preoperatorias más altas de PainDETECT, que miden las características del dolor neuropático, se asociaron con un mayor dolor tras el RTR. Este modelo fue capaz de explicar el 16 % de la varianza en las puntuaciones de dolor al inicio del estudio, el 12 % a los 3 meses, el 30 % a los 6 meses y el 20 % a los 12 meses. Para explorar más a fondo este hallazgo, evaluamos la correlación entre cada característica del dolor de PainDETECT y el dolor a los 12 meses, y descubrimos que un mayor dolor postoperatorio crónico se correlacionaba con una mayor frecuencia de sensaciones de quemazón (ρ = 0,46; IC del 95 %: (0,17; 0,69), p = 0,002), hormigueo o pinchazos (ρ = 0,43, IC del 95 %: (0,14, 0,68), p = 0,004), dolor con estímulos de frío o calor (ρ = 0,31, IC del 95 %: (0,002, 0,60), p = 0,043) y entumecimiento de la zona (ρ = 0,41, IC del 95 %: (0,12, 0,65), p = 0,006), véase la figura 3d.
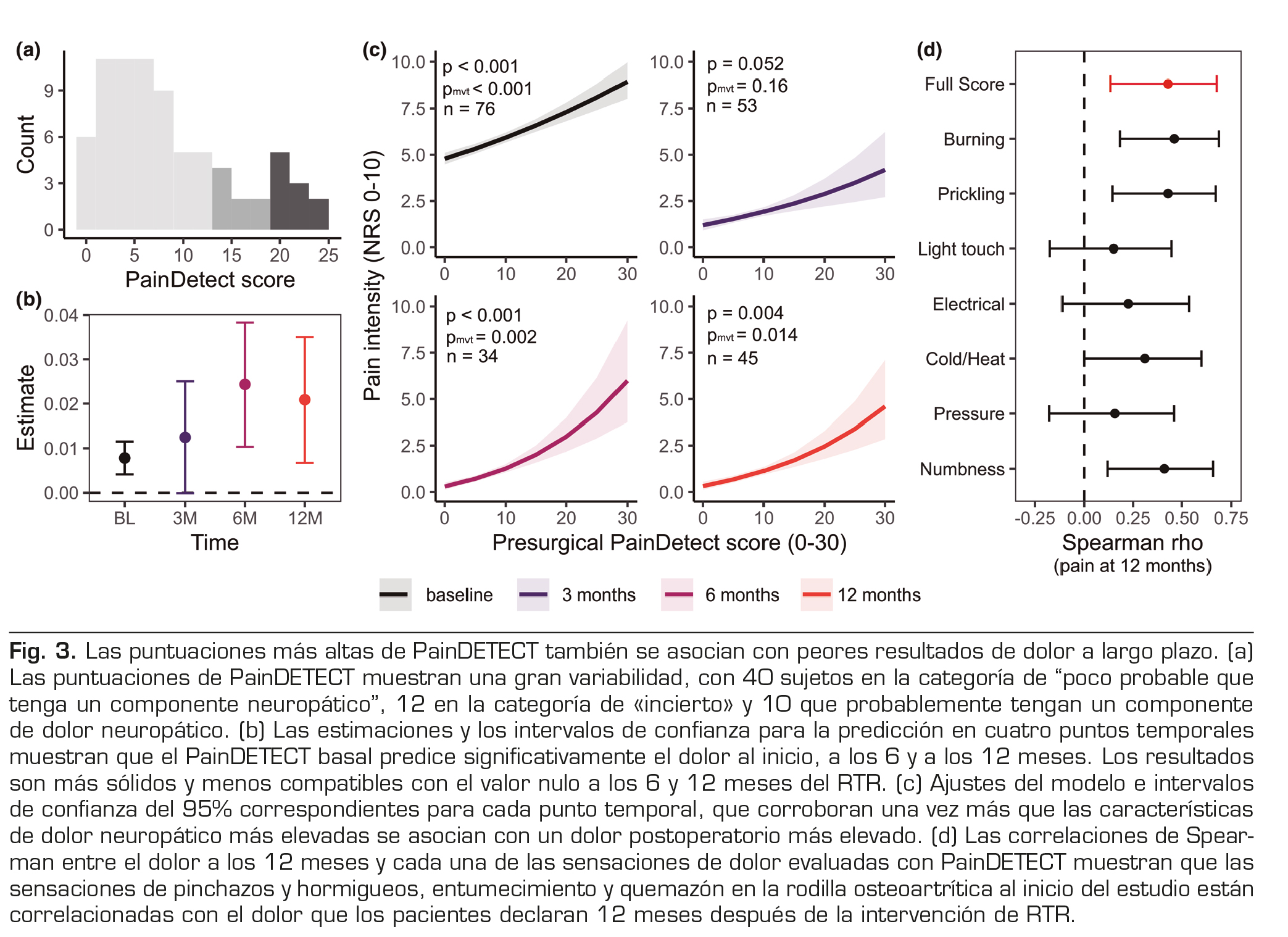
Modelización de la hiperalgesia y los síntomas neuropáticos
Dada la capacidad descrita anteriormente de las puntuaciones de hipoperalgesia por pinchazo y PainDETECT para predecir el dolor postoperatorio, se evaluó si captaban las mismas o diferentes fuentes de variación en los resultados del dolor. Además, también comprobamos si la capacidad predictiva de estas medidas se explica mejor por el dolor basal. Para ello, se seleccionaron los dos parámetros más significativos de los análisis anteriores (pinchazo 1 y puntuación PainDETECT) y, junto con el dolor basal, la edad y el sexo, se añadieron a un único modelo lineal multivariable que predecía la intensidad del dolor 12 meses después del RTR. Tanto el pinchazo 1 (β = 0,21; IC del 95 %: (0,02; 0,41), p = 0,030) como la puntuación PainDETECT (β = 0,02; IC del 95 %: (0; 0,03), p = 0,046) se asociaron de forma independiente con el dolor a los 12 meses, mientras que el dolor basal (β = 0,14; IC del 95 %: (-0,57, 0,80), p = 0,69), la edad (β = 0, IC 95 %: (-0,01, 0,02), p = 0,71) y el sexo (β = -0,07, IC 95 %: (-0,33, 0,19), p = 0,56) no fueron estadísticamente significativos. Las métricas de importancia relativa (24) mostraron que las puntuaciones de pinchazo 1 representaban el 15 % de la varianza única en los resultados del dolor (escala logarítmica), PainDETECT el 13 % de la varianza, el dolor basal el 4 % y la edad y el sexo el 0 %, apoyando así que las puntuaciones de pinchazo 1 y PainDETECT captan fuentes únicas de varianza en el dolor clínico 1 año después del RTR.
Cambios en la hiperalgesia y resultados a largo plazo
Por último, los pacientes volvieron para una evaluación de los QST a los 3 y 6 meses de la intervención. Treinta y seis pacientes volvieron a los 3 meses y 25 a los 6 meses. Se utilizó un modelo lineal con los valores de punción basales y (i) el cambio desde el valor basal a los 3 meses o (ii) el cambio desde el valor basal a los 6 meses para predecir el dolor a los 12 meses tras ajustar por edad y sexo. Este modelo pretendía evaluar si los cambios en los parámetros QST anormales (es decir, su persistencia o reversión) pueden relacionarse además con los resultados a largo plazo. A los 3 meses, este modelo de dos parámetros muestra que tanto los valores basales (β = 0,545; IC del 95 %: (0,29, 0,80), p < 0,001) como su cambio (β = 0,38, IC 95 %: (0,11, 0,65), p = 0,008) predicen el resultado. Más concretamente, un mayor dolor por pinchazo preoperatorio (Figura 4a) se asoció con un mayor dolor a largo plazo, incluso después de ajustar los cambios en estos parámetros. Además, una mayor disminución del dolor manifestado durante la estimulación por punción predijo un menor dolor clínico a largo plazo tras ajustar el dolor basal (Figura 4b). En otras palabras, las mejoras en la hiperalgesia mecánica (es decir, los cambios negativos) se asociaron con un menor dolor clínico a los 12 meses, y viceversa (Figura 4c). En conjunto, el modelo completo explicaba el 67 % de la varianza del dolor a los 12 meses (F4,19 = 5,50, p = 0,004, R2 = 0,67, R2 aj. = 0,63), aunque hay que tener cuidado al interpretar este tamaño del efecto debido al pequeño tamaño de la muestra (n = 24). Sorprendentemente, este resultado no se observó para el cambio a los 6 meses del postoperatorio: mientras que los parámetros basales seguían prediciendo los resultados (β = 0,39; IC del 95 %: (0,03, 0,75), p = 0,036), su cambio desde el inicio hasta los 6 meses no fue estadísticamente significativo (β = 0,03; IC del 95 %: (-0,40, 0,46), p = 0,89). El modelo completo a los 6 meses no predijo significativamente el dolor a los 12 meses (F4,13 = 2,02, p = 0,15, véase la Figura 4d-f).
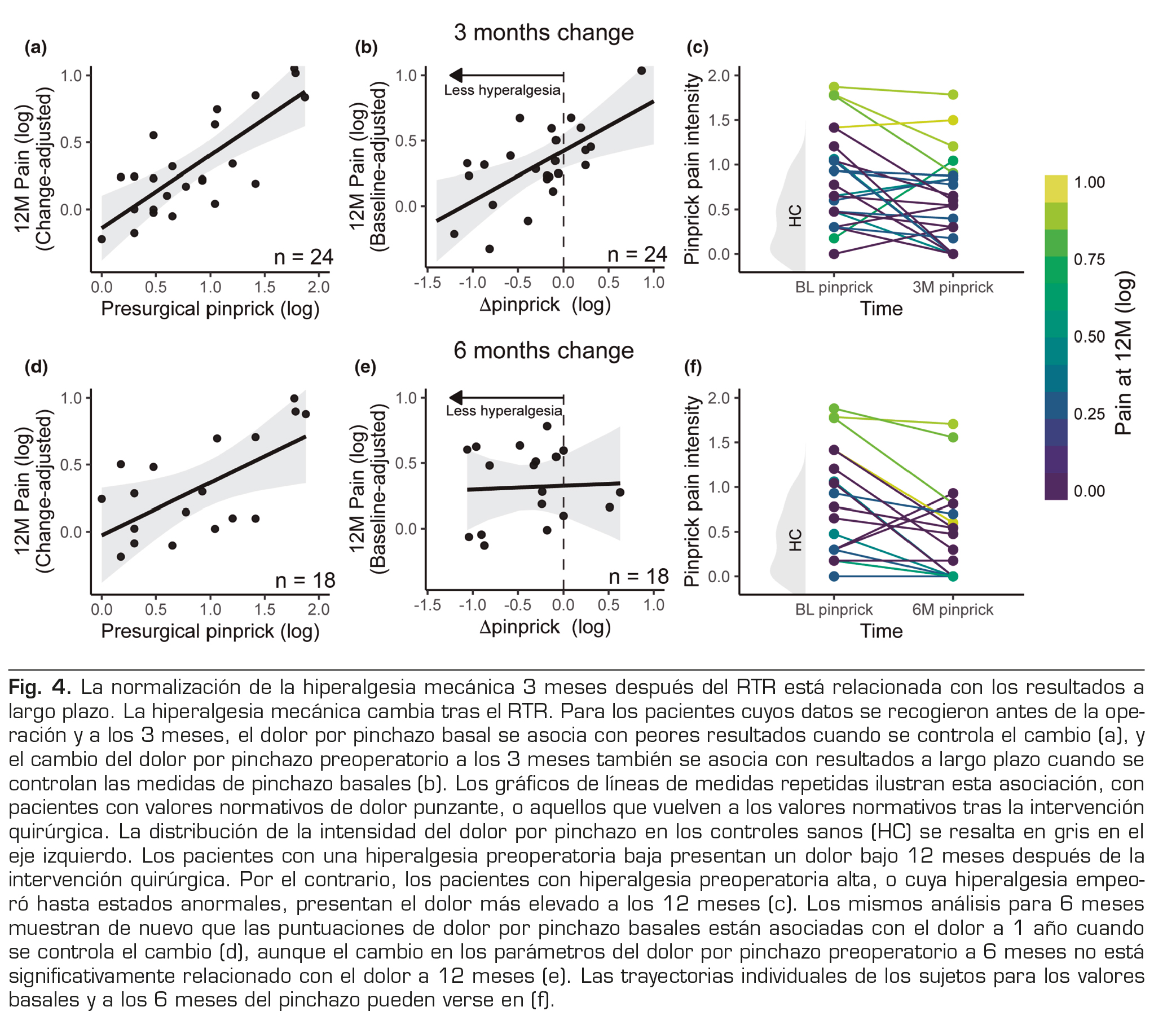
OBJETIVO DE DISCUSIÓN
El presente estudio halló que los pacientes con KOA mostraban hiperalgesia mecánica y PTT disminuido, pero por lo demás, parámetros de QST normales en comparación con los controles sanos. La hiperalgesia preoperatoria por pinchazo y las cualidades similares al dolor neuropático predecían la intensidad del dolor prequirúrgico y postoperatorio al año. Además, las mejoras en la hiperalgesia a los 3 meses predijeron menos dolor un año después de la cirugía y, junto con la hiperalgesia preoperatoria, este modelo captó el 67 % de la varianza en el dolor postoperatorio a los 12 meses.
Los pacientes con OA muestras hiperalgesia pero, por lo demás, parámetros de QST normales
Cada vez hay más pruebas de que los pacientes con OA presentan diversas anomalías sensoriales localizadas o generalizadas (6,8), que se cree que reflejan una mayor ganancia en las vías nociceptivas. En este estudio, los pacientes con KOA informaron de niveles más altos de dolor evocado en respuesta tanto a un único pinchazo como a una serie de 10 pinchazos consecutivos y tenían un PTT de manguito más baja en comparación con los controles sanos. La KOA se asocia a menudo con hiperalgesia a la presión en comparación con individuos sanos sin dolor (para una reseña, véase de Oliveira Silva y cols. [25]). Los estudios que utilizan evaluaciones de pinchazo también encuentran que los pacientes con KOA presentan hiperalgesia en la piel sobre la rodilla afectada (26,27) y que la magnitud de esta hiperalgesia está asociada con la gravedad de la enfermedad de OA (26). La hiperalgesia a estímulos mecánicos es un indicador común de sensibilización periférica, y potencialmente también de sensibilización a nivel de la médula espinal, dado el bombardeo crónico y continuo de señalización nociceptiva en la OA (28,29). Observamos una hiperalgesia significativa en el compartimento medial de la rodilla y, en menor grado, en la pantorrilla. Estas áreas se solapan en sus respectivos dermatomas y corresponden a los mismos segmentos espinales (30), lo que podría indicar la implicación de la sensibilización central. Por otra parte, las diferencias en el tamaño de los efectos de los estímulos de pinchazo y presión son notables, con una hiperalgesia más pronunciada cerca de la rodilla. Además de la ubicación, los estímulos de presión se dirigen principalmente a nociceptores de tejido profundo ricos en fibras C, mientras que los estímulos de pinchazo también se dirigen a nociceptores A-delta a nivel cutáneo (31,32,33), por lo que se necesitan más estudios para comprender la contribución relativa de los mecanismos centrales frente a los periféricos.
No se encontraron diferencias entre los pacientes con KOA y los controles sanos en todos los demás parámetros de QST recogidos, incluida la TS, que tradicionalmente se considera un marcador de la sensibilización central, y la CPM, que aquí se toma como un indicador indirecto de la modulación descendente. Estudios previos han demostrado que los pacientes con KOA presentan TS facilitada y CPM alterada (6,9,18). Sin embargo, los hallazgos en este campo siguen siendo ambiguos (34,35). Nuestros resultados podrían sugerir que los tamaños del efecto para estas medidas son pequeños; por lo tanto, los estudios con tamaños de muestra de pequeños a medianos pueden tener baja potencia, arrojando resultados que caen a ambos lados del umbral de «significación estadística». Alternativamente, también podría sugerir que las anomalías de la CPM y la ST no están universalmente presentes en los pacientes con OA y solo se encuentran en un subconjunto de pacientes, posiblemente como consecuencia de la severidad de la enfermedad, la duración y otros factores subyacentes, en consonancia con las recientes propuestas de la existencia de múltiples fenotipos de osteoartritis (7,36).
Por último, cabe señalar que existe una gran heterogeneidad en los métodos de QST (12), con probables consecuencias en los resultados observados (37). Por ejemplo, en la evaluación de la CPM, los estímulos condicionados pueden ser de una modalidad diferente (por ejemplo, calor, frío y dolor isquémico) y también aplicarse en zonas corporales distantes (por ejemplo, el brazo). En este caso, aplicamos los estímulos condicionados en la pierna contralateral, lo que mostró diferencias entre los controles sanos y los pacientes con OA (18), pero queda por determinar si esta elección metodológica influyó en los resultados.
Las puntuaciones de intensidad del dolor mecánico predicen los resultados del dolor a largo plazo
Nuestro estudio demostró que una mayor hiperalgesia mecánica al inicio de la intervención, en concreto el pinchazo 1, se asocia con un mayor dolor preoperatorio y predice los resultados postoperatorios.
Este hallazgo tiene un significado traslacional importante, ya que la predicción es más fuerte para el dolor a los 12 meses después de la cirugía, cuando el proceso de curación debería haberse completado. Existen pruebas de que los PPT preoperatorios medidos en el lugar de la lesión pueden predecir los resultados del dolor a largo plazo (véase una revisión en Paredes y cols. [38]), lo que respalda la idea de que un procesamiento nociceptivo preoperatorio anómalo está relacionado con la persistencia del dolor tras la cirugía. Comparativamente, menos estudios han analizado las calificaciones preoperatorias de intensidad del dolor de von Frey o de pinchazo para predecir el dolor postoperatorio después del reemplazo total de la articulación: un estudio encontró que la intensidad del dolor informada durante la evaluación de von Frey antes del RTR puede predecir el dolor 2 días después de la cirugía (39), pero no el dolor con el rango de movimiento 6 meses después de la cirugía (40), y para el reemplazo total de cadera, no se encontraron asociaciones entre la intensidad del pinchazo prequirúrgico y el dolor 6 semanas después del reemplazo total de cadera (19). Se necesitan estudios futuros para aclarar la generalizabilidad de nuestros hallazgo.
Curiosamente, el tren de 10 estímulos (pinchazo 10) mostró una menor capacidad predictiva que un solo pinchazo. Una posible explicación es que pedir a los pacientes que valoren un dolor medio para 10 estímulos introduce un sesgo que no está presente cuando los sujetos se centran en un solo pinchazo. Alternativamente, también podría sugerir que la puntuación media del dolor con estimulaciones repetidas mezcla eficazmente los efectos de la hiperalgesia con el wind-up, confundiendo así la capacidad predictiva de esta medida. Por último, dado que los resultados del dolor a los 12 meses se explicaron mejor por el segundo ensayo de pinchazo que por el primero, es poco probable que las expectativas influyeran en nuestros resultados.
No encontramos ningún otro parámetro preoperatorio de QST que se asociara de forma estadísticamente significativa con los niveles de dolor previos al RTR ni que predijera el dolor postoperatorio. Otros estudios han hallado que la TS alta y la CPM alterada predicen la intensidad del dolor postoperatorio después de la cirugía TKR (18,41,42,43,44,45,46,47,48,49). Sin embargo, es importante señalar que, de nuevo, existen resultados en gran medida inconsistentes en relación con el valor predictivo de los QST (12,38). Además, en nuestra muestra, ninguna de las medidas anteriores se desviaba apreciablemente de los controles sanos en primer lugar, lo que sugiere que no eran “anormales”. Esto también podría desempeñar un papel en nuestros resultados nulos —quizás estas medidas solamente sean predictivas en subgrupos de pacientes que muestran CPM o TS anormales.
Los síntomas neuropáticos también predicen los resultados a largo plazo
Está bien establecido que las anomalías sensoriales, incluidas la alodinia y la hiperalgesia, son síntomas característicos de las lesiones neuropáticas (29,50,51). Aunque históricamente la OA se ha considerado un modelo de dolor nociceptivo, numerosos datos cuestionan esta noción (2,30,52) y, de hecho, los pacientes con OA informan con frecuencia de síntomas de dolor neuropático (17,53,54). Además, los pacientes de OA con mayores síntomas de dolor neuropático también presentan hiperalgesia mecánica (17), lo que sugiere una relación entre ambos. Y lo que es más importante, la presencia de características de dolor neuropático se ha planteado como un predictor del dolor crónico posquirúrgico después del RTR (14,55), y un estudio anterior sugiere que las puntuaciones de PainDETECT pueden predecir los resultados del dolor a largo plazo después del RTR por encima del valor predictivo de la hiperalgesia (18).
Nuestros datos sugieren que los síntomas preoperatorios similares al dolor neuropático, evaluados mediante la puntuación PainDETECT, fueron predictivos de los resultados postoperatorios a los 6 y 12 meses de la cirugía. Es importante destacar que las puntuaciones de dolor de pinchazo 10 (y, en menor medida, las puntuaciones de dolor de pinchazo 1) se correlacionaron con la escala PainDETECT, lo que podría interpretarse como que los valores de pinchazo y PainDETECT se refieren a los mismos mecanismos subyacentes. Para probar esto explícitamente, controlando al mismo tiempo el dolor preoperatorio, creamos un modelo multivariable y descubrimos que las características del dolor neuropático y la hiperalgesia explican una varianza única en los resultados del dolor, mientras que el dolor basal es menos importante en presencia de estos dos parámetros. Esto sugiere que la hiperalgesia y el dolor neuropático reflejan mecanismos sinérgicos pero independientes.
La normalización de la hiperalgesia tras la cirugía se asocia a resultados a largo plazo
Hicimos un seguimiento de los pacientes tras el RTR para comprender cómo se relacionarían los parámetros de QST anormales a los 3 y 6 meses de la cirugía con los resultados a largo plazo. Estudios anteriores han demostrado que los PPT anormales al algómetro de presión manual y las CPM anormales tienden a normalizarse después del RTR si la cirugía alivia el dolor (56); esta normalización podría estar asociada con mejores resultados después de la cirugía (45). Nuestros hallazgos apoyan estas nociones, ya que el cambio en la intensidad del pinchazo desde el inicio hasta 3 meses después del RTR se correlaciona con los informes de dolor 1 año después del RTR, incluso cuando se controlan las puntuaciones de pinchazo preoperatorias. El dolor por pinchazo preoperatorio siguió siendo un predictor estadísticamente significativo de los resultados a largo plazo al controlar también su cambio, posiblemente debido al hecho de que los pacientes con hiperalgesia alta son también los que tienen menos probabilidades de cambiar. Sorprendentemente, este resultado no fue consistente cuando se evaluaron los cambios a los 6 meses. Aunque especulativo, este resultado podría sugerir un proceso continuo en el que el dolor postoperatorio con el tiempo depende menos de mecanismos periféricos y más de distintas propiedades neuroplásticas, en particular en el cerebro (57). Futuros análisis que examinen los parámetros cerebrales y sus cambios en estos puntos temporales podrían diferenciar entre estas opciones.
Limitaciones
Este estudio presenta algunas limitaciones. Los datos se recogieron durante la pandemia de COVID-19, lo que afectó a las tasas de retención y también podría haber influido en los resultados de dolor de los pacientes.
En consecuencia, muchos pacientes se perdieron durante el seguimiento, lo que disminuyó la precisión de nuestras estimaciones. El pequeño tamaño de la muestra también nos impidió desarrollar modelos de predicción no sesgados (es decir, predicción fuera de la muestra) con una validación rigurosa. Además, no instruimos a nuestros pacientes con KOA para que suspendieran el uso de analgésicos antes de la cita para la investigación, lo que podría afectar a sus umbrales de dolor y sensibilidad al dolor. Por último, nuestra muestra estaba compuesta por un 70% de hombres, en consonancia con la mayor prevalencia conocida de OA de rodilla en mujeres; ajustamos por sexo en todos los análisis, pero debido a la falta de potencia estadística para estudiar los efectos principales y las interacciones del sexo (58), no estudiamos los efectos específicos del sexo.
APORTACIONES DE LOS AUTORES
ADV realizó análisis de datos y redactó, editó y revisó el manuscrito. OJC recopiló datos y redactó el manuscrito original. CBP recopiló datos y redactó el manuscrito original. JP recopiló datos. JB, KK y LN redactaron y revisaron el manuscrito. DM y KH realizaron las cirugías y proporcionaron información clínica. AVA firmó el estudio y editó y revisó el manuscrito. PB recopiló datos, realizó análisis de datos y redactó, editó y revisó el manuscrito. Todos los autores discutieron los resultados y contribuyeron y aprobaron el manuscrito final.
FINANCIACIÓN
Este trabajo ha sido financiado por los Institutos Nacionales de Salud con subvenciones a AVA: P50 DA044121 y R01AR074274. El Centro de Neuroplasticidad y Dolor (CNAP) cuenta con el apoyo de la Fundación Nacional Danesa de Investigación (DNRF121). El Centro de Modelización Matemática de la Osteoartritis de Rodilla (MathKOA) está financiado por la Fundación Novo Nordisk (NNF21OC0065373).
DECLARACIÓN DE CONFLICTO DE INTERESES
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
ORCID
Andrew D. Vigotsky https://orcid.org/0000-0003-3166-0688
Paulo Branco https://orcid.org/0000-0002-9425-046X
INFORMACIÓN COMPLEMENTARIA
Encontrará más información complementaria online en la sección Información complementaria al final de este artículo.
BIBLIOGRAFÍA