
doi.org/10.1002/ejp.2265
ARTÍCULO DE LA REVISTA EJP
Trayectorias del dolor y síntomas de dolor neuropático tras la cirugía de cáncer de pulmón: estudio de cohorte prospectivo
Pain trajectories and neuropathic pain symptoms following lung cancer surgery: a prospective cohort study
A. V. Danielsen1,2
J. J. Andreasen1,2
B. Dinesen3
J. Hansen4
K. K. Petersen5
K. S. Duch6
J. Bisgaard7
C. Simonsen1
L. Arendt-Nielsen5,8,9
1Departamento de Cirugía Cardiotorácica. Hospital universitario de Aalborg. Aalborg, Dinamarca
2Departamento de Medicina Clínica. Universidad de Aalborg. Aalborg, Dinamarca
3Laboratorio de Tecnologías del Bienestar - Salud Digital y Rehabilitación. Universidad de Aalborg, Dinamarca. Departamento de Cienciay Tecnología de la Salud. Facultad de Medicina. Universidad de Aalborg. Aalborg, Dinamarca
4Grupo de Investigación CardioTech. Departamento de Ciencia y Tecnología de la Salud. Facultad de Medicina. Universidad de Aalborg. Aalborg, Dinamarca
5Centro de Neuroplasticidad y Dolor (CNAP). SMI. Departamento de Ciencia y Tecnología de la Salud. Facultad de Medicina. Universidad de Aalborg. Aalborg, Dinamarca
6Investigación de Datos y Bioestadística. Hospital Universitario de Aalborg. Aalborg, Dinamarca
7Departamento de Anestesiología y Cuidados Intensivos. Hospital Universitario de Aalborg. Aalborg, Dinamarca
8Centro de Diabetes Steno. Hospital Universitario de Aalborg. Aalborg, Dinamarca
9Departamento de Gastroenterología y Hepatología. Mech-Sense. Instituto clínico. Hospital Universitario de Aalborg. Aalborg, Dinamarca
RESUMEN
Antecedentes: El dolor postquirúrgico persistente (PPSP) tras la cirugía del cáncer de pulmón es frecuente y las definiciones actuales se basan en evaluaciones en un único momento tras la cirugía. Sin embargo, la intensidad del dolor y los síntomas pueden fluctuar y cambiar con el tiempo, y verse afectados por factores múltiples y cambiantes. Se necesitan estudios de los patrones de recuperación postoperatoria y de la transición del dolor agudo al crónico para seguir investigando medidas preventivas y tratamientos que modifiquen las trayectorias de recuperación desfavorables.
Métodos: En este estudio exploratorio, 85 pacientes sometidos a cirugía por cáncer de pulmón presunto o confirmado informaron bimensualmente sobre la intensidad del dolor durante 12 meses. Se investigaron las trayectorias del dolor durante la recuperación, utilizando modelos de trayectorias basados en grupos. También se estudiaron las asociaciones con posibles factores de riesgo de PPSP, incluidas variables clínicas y la puntuación de ansiedad y depresión (HADS).
Resultados: Se calculó un modelo de trayectoria que contenía tres grupos de recuperación del dolor a los 12 meses. Un grupo sin PPSP se recuperó totalmente (50 %) en un plazo de dos a tres meses. Otro grupo con PPSP de intensidad leve siguió una trayectoria de recuperación prolongada (37 %), mientras que en el último grupo se observó una recuperación incompleta (13 %). El dolor postoperatorio agudo y la menor edad se asociaron a una trayectoria de recuperación menos favorable. Se observaron más síntomas de dolor neuropático en los pacientes con recuperación incompleta.
Conclusiones: Se identificaron tres trayectorias de recuperación clínicamente relevantes, basadas en un seguimiento exhaustivo del dolor. La mayor intensidad del dolor postoperatorio agudo se asoció a una trayectoria de recuperación del dolor desfavorable.
Declaración de importancia: Comprender la transición del dolor postoperatorio agudo al crónico e identificar los factores de riesgo preoperatorios es esencial para el desarrollo de tratamientos específicos y la aplicación de medidas preventivas. Este estudio: 1) identificó distintas trayectorias de recuperación basadas en seguimientos frecuentes de evaluación del dolor durante 12 meses después de la cirugía; y 2) evaluó los factores de riesgo de trayectorias de recuperación del dolor postoperatorio desfavorables. Los resultados sugieren que una mayor intensidad del dolor postoperatorio al inicio se asocia con una trayectoria de recuperación desfavorable a largo plazo.
ABSTRACT
Background: Persistent postsurgical pain (PPSP) after lung cancer surgery is common and current definitions are based on evaluations at a single time point after surgery. Pain intensity and symptoms may however fluctuate and change over time, and be impacted by multiple and shifting factors. Studies of postopera- tive recovery patterns and transition from acute to chronic pain are needed for further investigation of preventive measures and treatments to modify unfavourable recovery paths.
Methods: In this explorative study, 85 patients undergoing surgery due to either presumptive or confirmed lung cancer reported pain intensities bi-monthly for 12 months. Pain trajectories during recovery were investigated, using group-based trajectory modelling. Associations with possible risk factors for PPSP, including clinical variables and anxiety and depression score (HADS), were also explored.
Results: A trajectory model containing three 12-month pain recovery groups was computed. One group without PPSP fully recovered (50 %) within two to three months. Another group with mild-intensity PPSP followed a protracted recovery trajectory (37 %), while incomplete recovery was observed in the last group (13 %). Acute postoperative pain and younger age were associated with a less favourable recovery trajectory. More neuropathic pain symptoms were observed in patients with incomplete recovery.
Conclusions: Three clinically relevant recovery trajectories were identified, based on comprehensive pain tracking. Higher acute postoperative pain intensity was associated with an unfavourable pain recovery trajectory.
Significance Statement: Understanding the transition from acute to chronic post- operative pain and identifying preoperative risk factors is essential for the develop- ment of targeted treatments and the implementation of preventive measures. This study (1) identified distinct recovery trajectories based on frequent pain assessment follow-ups for 12 months after surgery and (2) evaluated risk factors for unfavourable postoperative pain recovery paths. Findings suggest that early higher postoperative pain intensity is associated with an unfavourable long-term recovery path.
Correspondencia: A. V. Danielsen
a.danielsen@rn.dk
Recibido: 30–08-2023
Aceptado: 05-03-2024
INTRODUCCIÓN
El dolor posquirúrgico persistente (PPSP) es común en la mayoría de los campos de la cirugía (1). El consenso actual define el PPSP como cualquier dolor nuevo, que ocurre después de un procedimiento quirúrgico en relación con el área de la cirugía, que persiste más allá de dos o tres meses (2). La incidencia del PPSP tras la cirugía de cáncer de pulmón sigue siendo alta, independientemente del uso creciente de técnicas mínimamente invasivas, con prevalencias comunicadas del 30 al 60 % (3). La mayoría de los estudios previos evalúan el resultado del dolor crónico en un único punto temporal, normalmente entre tres y 12 meses después de la cirugía (4,5,6,7,8). Sin embargo, la intensidad del dolor y los síntomas pueden fluctuar, y la percepción y el impacto del dolor crónico pueden verse influidos por muchos factores que no se atribuyen necesariamente a un traumatismo quirúrgico específico o a una afección subyacente (9,10).
El tratamiento óptimo del dolor es un aspecto clave en los protocolos actuales y en evolución de la recuperación mejorada tras la cirugía (ERAS) (11). La evaluación individualizada del riesgo de dolor y la identificación de posibles factores de riesgo pre y perioperatorios modificables se consideran enfoques centrales y pragmáticos para las intervenciones de tratamiento dirigidas a prevenir la transición del dolor agudo al crónico (12,13,14). Se han explorado varios posibles predictores de PPSP después de la cirugía torácica, por ejemplo, pruebas sensoriales cuantitativas (QST), dolor crónico preoperatorio, dolor postoperatorio agudo, factores psicológicos, patrón de sueño y comorbilidades (4,15,16,17,18,19,20) sin hallazgos consistentes a excepción del dolor postoperatorio agudo y posiblemente el dolor preexistente (21). Las asociaciones entre los posibles predictores del PPSP y los resultados del dolor basados en las trayectorias del dolor a largo plazo tras la cirugía solo se han investigado en unos pocos estudios (6,18,22,23,,24,25). Este enfoque es de especial interés, ya que puede permitir la elaboración de perfiles de riesgo de PPSP preoperatorios y proporcionar información sobre cuándo divergen las trayectorias de recuperación, indicando así el momento oportuno para intervenir con el fin de aliviar o prevenir una trayectoria de recuperación desfavorable.
Los objetivos de este estudio exploratorio eran realizar un seguimiento quincenal de la intensidad del dolor postoperatorio durante un periodo de 12 meses en una cohorte de pacientes sometidos a cirugía de cáncer de pulmón e identificar posibles factores de riesgo preoperatorios para el PPSP. Las hipótesis eran: 1) que podrían identificarse distintas trayectorias del dolor en pacientes que desarrollan PPSP, con la opción de detectar el intervalo de tiempo en el que las trayectorias empiezan a divergir; 2) que estas distintas trayectorias del dolor estaban asociadas con factores de riesgo preoperatorios para el PPSP (dolor postoperatorio agudo, edad, sexo, abordaje quirúrgico y síntomas psicológicos); y, por último, 3) que los síntomas de dolor neuropático son comunes y más pronunciados en el PPSP tras la cirugía de cáncer de pulmón.
MÉTODOS
Población de estudio y selección de pacientes
Los pacientes remitidos para cirugía electiva con cáncer de pulmón primario confirmado o presunto fueron seleccionados de forma consecutiva durante un periodo de tres años, desde mayo de 2014 hasta abril de 2018. Los criterios de inclusión fueron: edad ≥ 18 años, dominio de la lectura y comprensión del danés y programación de cirugía torácica con resección pulmonar. Los criterios de exclusión fueron abuso activo o previo de drogas y/o sustancias, dolor preexistente, cancelación de la cirugía o reintervención, incapacidad para cooperar en la evaluación preoperatoria y diagnóstico de cáncer sincrónico distinto del cáncer de pulmón primario.
La muestra de este estudio exploratorio basado en la trayectoria procedía de un estudio de cohortes más amplio que evaluaba los factores de riesgo preoperatorios del dolor crónico postoracotomía (26).
Recogida de datos
Se realizó una evaluación basal entre uno y tres días antes de la intervención en relación con la evaluación clínica preoperatoria rutinaria.
Escala de ansiedad y depresión hospitalaria preoperatoria (HADS)
Los síntomas preoperatorios de ansiedad y depresión se evaluaron mediante la escala HADS, que contiene catorce apartados sobre ansiedad y depresión con una puntuación de 0 a 3 para cada apartado, con subpuntuaciones máximas de ansiedad y depresión de 21 y una puntuación total combinada de 42. La HADS se utiliza ampliamente y se valora también en pacientes con cáncer (27).
Inventario de síntomas de dolor neuropático (NPSI)
Los síntomas de dolor neuropático se evaluaron mediante el NPSI al inicio y a los seis y doce meses de la intervención quirúrgica. El NPSI contiene cinco dimensiones (ardor, presión, paroxismo, evocación y disestesia) evaluadas mediante una escala de valoración numérica (NRS) de 0 (ausencia de dolor) a 10 (el peor dolor imaginable) para cada dimensión hasta una puntuación NPSI máxima de 50 (28).
Pruebas sensoriales preoperatorias
La alodinia en la zona de la operación se evaluó mediante un cepillo sensorial estándar (Somedic production AB, Suecia) en el que se indicó a los participantes que informaran de la sensación durante la estimulación como tacto ligero o desagradable/doloroso. La hiperalgesia se evaluó mediante estimulación punzante ponderada con fuerza creciente (3,2, 6, 4, 12,8, 25,6, 50,1 y hasta 60,0 mN) en ambos lados de la pared torácica hasta que el paciente informó de un dolor punzante. La prueba se inició en el lado contralateral opuesto a la zona de la operación (ipsilateral).
Características clínicas
Los datos demográficos, el tipo de intervención quirúrgica y el abordaje mediante toracotomía anterolateral o VATS (cirugía toracoscópica asistida por vídeo), la anestesia regional y la histología tumoral se extrajeron de los historiales médicos electrónicos.
Encuesta sobre el dolor continuo
Durante el seguimiento, se enviaron cuestionarios cada 2 semanas durante los 12 meses siguientes a la intervención. Los participantes informaron sobre la intensidad del dolor evocado por el movimiento, el dolor en reposo y la evolución del dolor, que se describió como ausencia de dolor, dolor constante con ligeras fluctuaciones, dolor constante con crisis de dolor, crisis de dolor sin dolor intermedio y crisis de dolor frecuentes. La intensidad del dolor se registró mediante la escala NRS.
Análisis estadísticos
Las variables continuas se presentan como medias con desviaciones estándar (DE) o medianas con rango intercuartílico (RIQ), según proceda, tras la evaluación de la normalidad mediante gráficos QQ. Las comparaciones de los análisis univariantes de los posibles predictores se realizaron mediante ANOVA unidireccional con la prueba de Tukey para determinar las estimaciones de las diferencias en las comparaciones múltiples, y las pruebas de rango con signo de Kruskal-Wallis y Wilcoxon, según procediera. Las variables categóricas se compararon mediante la prueba de chi-cuadrado de Pearson.
Se utilizó la modelización de trayectorias múltiples para calcular trayectorias basadas en datos múltiples en lugar de utilizar grupos preespecificados (29). El modelado de trayectorias múltiples es un método para el modelado de trayectorias basado en grupos (GBTM) y se realizó utilizando STATA versión 16.1 (StataCorp) con el paquete traj (29,30). Se investigaron tres modelos normales censurados, utilizando de dos a cuatro gráficos de trayectoria de la intensidad del dolor con diferentes términos de orden lineal a cúbico. Los modelos se evaluaron mediante el criterio de información bayesiano (BIC) y el criterio de información de Akaike (AIC), donde los valores más bajos representan un mejor ajuste del modelo. Las clasificaciones de grupos dentro de cada modelo se evaluaron mediante tres valoraciones: la probabilidad media de pertenencia a un grupo, la valoración gráfica de las curvas de trayectoria y la entropía, que denota la separación entre clases y grupos, donde los valores más próximos a 0 indican una separación deficiente y un valor de 1 significa una separación óptima. En la evaluación de los modelos se aplicó el principio de parsimonia, favoreciendo el modelo más sencillo sin pérdida de información clínicamente relevante. La selección final del modelo se basó en la evaluación estadística del ajuste del modelo, la mediana del número de observaciones en cada grupo, la evaluación gráfica y la aplicación clínica con respecto a las intensidades de dolor entre los grupos (31).
Los síntomas neuropáticos se evaluaron mediante el NPSI al inicio, 6 y 12 meses después de la cirugía, y se compararon en relación con la trayectoria del dolor. Los síntomas de dolor neuropático postoperatorio emergentes o aumentados se definieron como cualquier aumento del NPSI en comparación con el valor basal.
Los participantes con datos incompletos fueron excluidos de los análisis individuales. Los análisis estadísticos se realizaron en el paquete de software STATA Versión 16.1, StataCorp. College Station, Texas.
Ética
El estudio fue aprobado por el Comité de ética en investigación sanitaria de la región de Dinamarca Norte (N-20140062) y realizado según la Declaración de Helsinki.
RESULTADOS
Estadísticas descriptivas y tasa de respuesta
Se reclutó a 211 pacientes y se excluyó a 39 (19,4 %) debido al dolor preoperatorio declarado y a 19 (9,5 %) debido a que se desconocía el estado del dolor preoperatorio. Un total de 85 pacientes (42 %) siguieron respondiendo durante el seguimientoy se incluyeron en los análisis finales. En la Figura 1 se presenta un diagrama de flujo de la muestra del estudio.

Figura 1. Diagrama de flujo de la inclusión y el seguimiento del estudio. Participantes retirados y excluidos por puntos temporales con indicación de los motivos.
En la Tabla 1 se presentan las características basales de la cohorte y los datos que faltan. Las variables basales que faltaban > 10 % ocurrieron en el dolor postoperatorio agudo máximo (16,5 %), sin que se registraran los motivos.

Las tasas de respuesta globales durante la encuesta continua sobre el dolor fueron altas, con una mediana (IQR) de 25 (20; 26) puntuaciones de dolor notificadas de 27 posibles desde el inicio hasta el final del seguimiento a los 12 meses. Siete participantes (8,2 %) informaron de puntuaciones de dolor inferiores a diez para el dolor evocado por el movimiento.
Trayectorias de recuperación
Las evaluaciones de los modelos investigados se presentan en la Tabla 2. Todos los modelos mostraron una entropía elevada, superior a 0,8, con probabilidades medias elevadas de pertenencia a grupos de trayectorias > 90 % entre clases. El modelo de dos clases mostró el mejor ajuste según el AIC y el BIC, pero sólo contenía dos grupos de trayectorias, lo que provocó la pérdida de información clínicamente relevante sobre las trayectorias de recuperación de los pacientes que declararon dolor de forma constante durante todo el seguimiento. El modelo de cuatro clases mostró el peor ajuste y relevancia clínica de las trayectorias.

Se eligió el modelo de tres clases porque presentaba un buen ajuste (probabilidad media de pertenencia a un grupo > 0,9 en todos los grupos con un valor de entropía de 0,94), e identificó tres trayectorias de recuperación clínicamente relevantes relacionadas con los resultados del PPSP después de 12 meses, que correspondían a tres vías de recuperación distintas: 1) Recuperación completa, en la que el dolor se resolvía en dos o tres meses (n = 43), 2) Recuperación prolongada, en la que el dolor era leve y disminuía más lentamente (n = 31), y 3) Recuperación incompleta, en la que el dolor permanecía de leve a moderado sin ninguna disminución significativa (n = 11). La mediana (IQR) del número de puntuaciones NRS notificadas dentro de los grupos de trayectoria fue de 25 (23; 26) en el grupo de recuperación completa, 25 (17; 27) en el grupo de recuperación prolongada y 23 (16; 26) en el grupo de recuperación incompleta. No hubo diferencias significativas en las tasas de respuesta entre los grupos de trayectoria (p = 0,47).
El modelo final se presenta en la Figura 2. Las distribuciones de las puntuaciones NRS comunicadas se presentan en la Figura 3. Las observaciones de NRS individuales subyacentes dentro de los grupos de trayectorias se presentan en el material suplementario (Figura S1 y Tabla S1), junto con las probabilidades individuales de pertenencia a los grupos de trayectorias (Tabla S2).
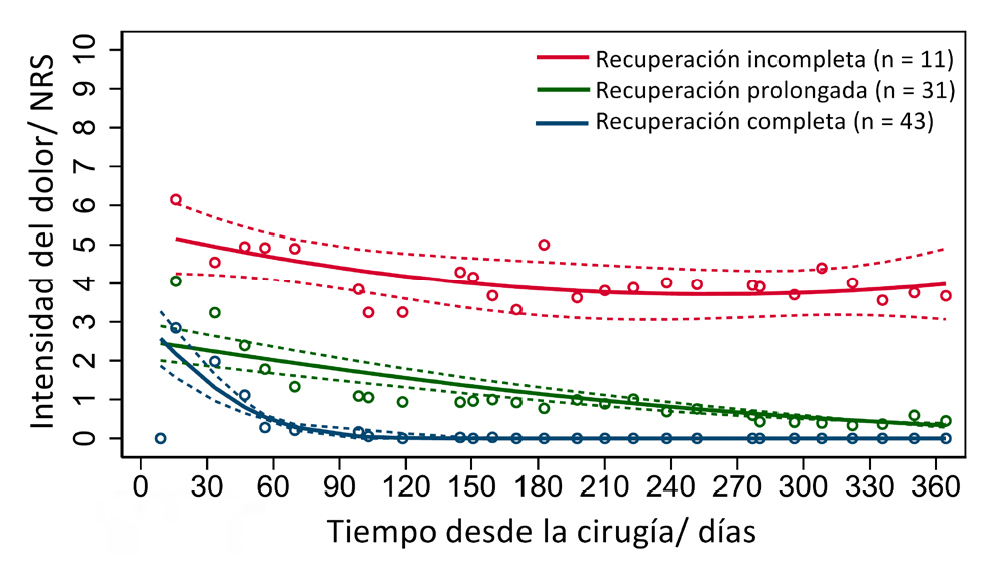
Figura 2. Trayectorias de recuperación postoperatoria a los doce meses tras una operación de cáncer de pulmón. Los puntos de datos individuales muestran la intensidad media del dolor provocado por el movimiento. Las líneas continuas muestran las trayectorias de cada grupo. Las líneas discontinuas indican los límites superior e inferior de los intervalos de confianza del 95%.
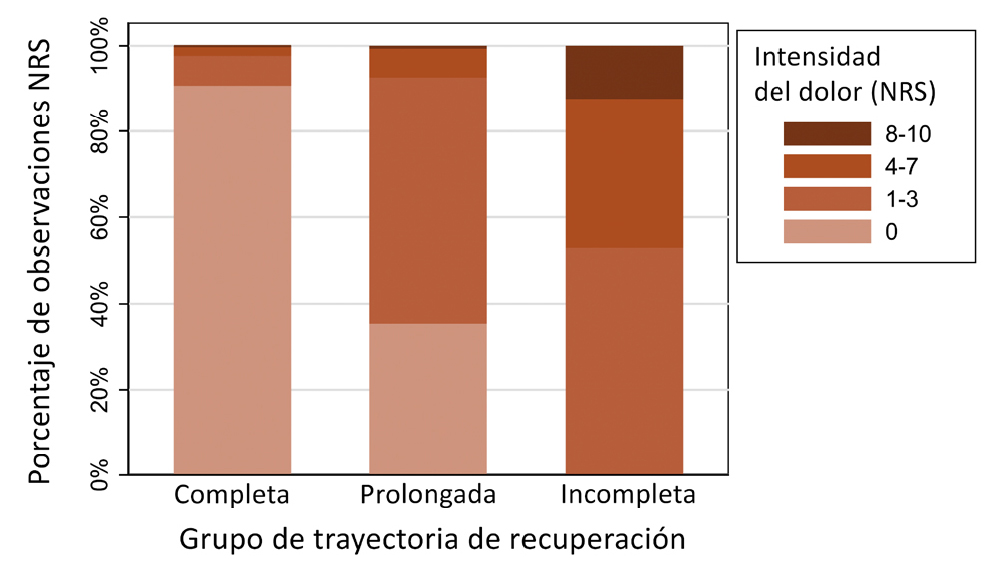
Figura 3. Distribuciones de las puntuaciones NRS en los grupos de trayectoria de recuperación.
A lo largo del seguimiento, las trayectorias siguieron siendo significativamente diferentes, sin superposición de intervalos de confianza más allá del primer mes, donde se observó una superposición entre los grupos de recuperación completa y prolongada (Figura 2). Un total de 43 participantes (50,1 %) no desarrollaron PPSP y siguieron una trayectoria descendente con recuperación completa (NRS = 0) después de 60-90 días. Los participantes que siguieron la trayectoria de recuperación prolongada (n = 31, 36,7 %) también mostraron una disminución del dolor y finalmente alcanzaron la recuperación hacia el final del seguimiento, con una media de NRS (IC del 95 %) de 0,34 (0,28; 0,39) después de 12 meses. Los participantes que siguieron la trayectoria de recuperación incompleta (n = 11, 13,2 %) no experimentaron ningún des-censo significativo de la intensidad del dolor durante el seguimiento, y su dolor se mantuvo constante, con una NRS media (IC del 95 %) de 4,0 (3,1; 4,9) al final del seguimiento.
Dolor neuropático
Ningún participante sufrió alodinia preoperatoria en relación con la zona quirúrgica prevista, evaluada mediante estimulación con pincel. Dos participantes (2,4 %) del grupo de recuperación completa presentaron diferencias en los umbrales de dolor por pinchazo al comparar el lado quirúrgico (ipsilateral) con el lado de control (contralateral); un participante informó de una disminución delumbral (3,2 g frente a 12,8 g) y otro de un aumento del umbral (ausencia de dolor frente a 60,0 g).
Se halló una relación significativa entre los síntomas de dolor neuropático postoperatorio emergente y aumentado y el PPSP, ya que los participantes que seguían la trayectoria de recuperación incompleta eran más propensos a informar de síntomas de dolor neuropático a los 6 meses (χ2 = 11,9, p < 0,01) y a los 12 meses (χ2 = 16,7, p < 0,01) (Tabla 3). Al comparar el ?NPSI, los participantes que siguieron la trayectoria de recuperación incompleta informaron de un mayor NPSI en comparación con los grupos de recuperación prolongada y completa. Sin embargo, sólo se observó una diferencia clínicamente modesta en el ΔNPSI (ΔNPSI medio 1,5 IQR (1,0; 4,3), p < 0,01). Los síntomas de dolor neuropático se notificaron con mayor frecuencia después de 12 meses en los grupos de trayectoria prolongada e incompleta en comparación con los participantes con recuperación completa. En la Tabla 3 se presenta una comparación de las puntuaciones NPSI y los síntomas de dolor neuropático entre los grupos de trayectoria. Todos los grupos de recuperación experimentaron un aumento significativo del NPSI desde el inicio hasta 6 meses después de la cirugía, pero no se observaron aumentos significativos entre el inicio y el final del seguimiento (Figura 4).

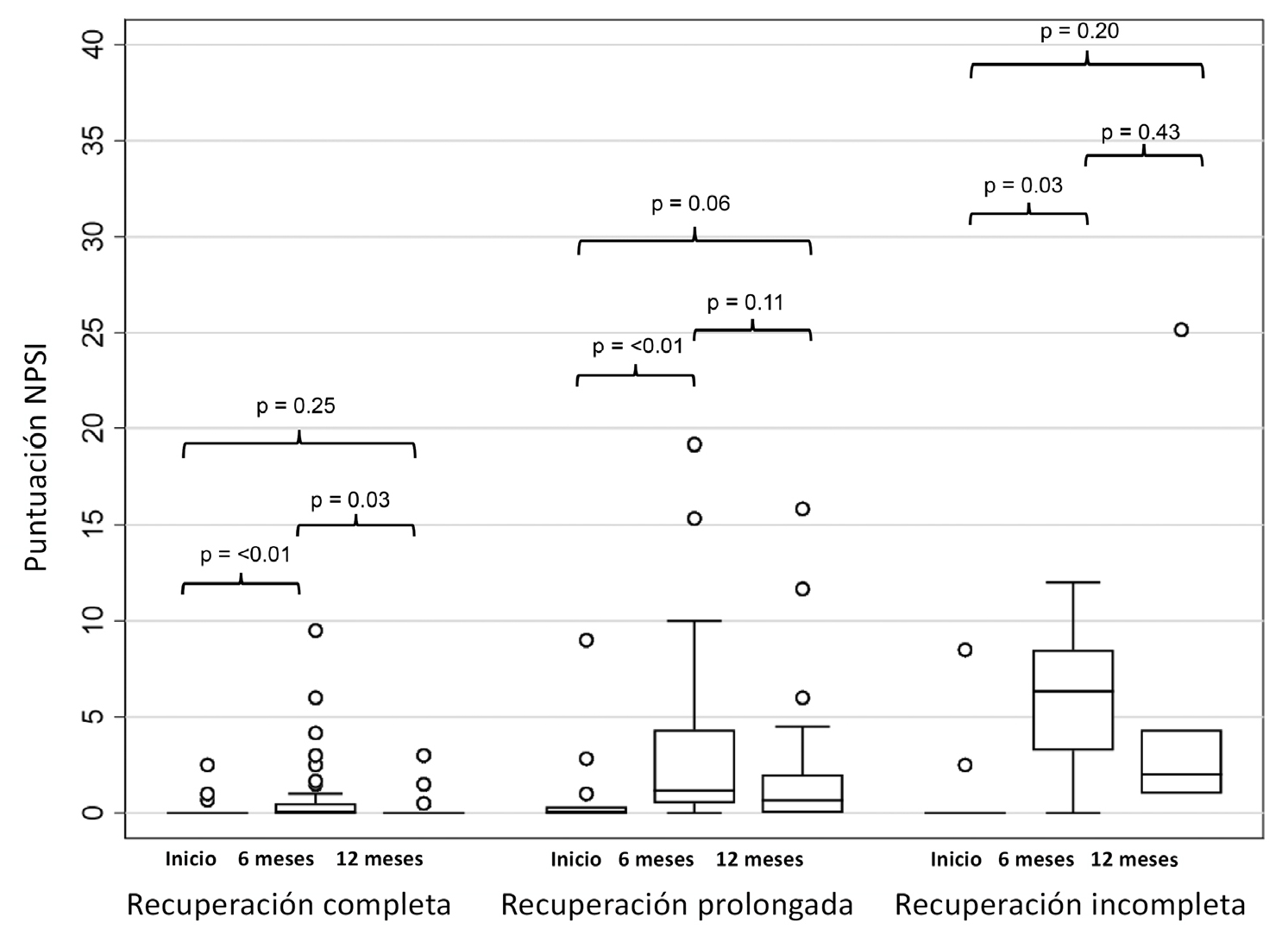
Figura 4. Puntuaciones del inventario de síntomas de dolor neuropático (NPSI) antes de la cirugía (punto de partida) y después de seis y 12 meses en relación con la trayectoria de recuperación. Las cajas muestran los cuartiles superior e inferior con la mediana indicada (línea). Los bigotes indican el máximo y el mínimo. Los puntos indican valores atípicos individuales. Valores p de los análisis de los cambios intragrupo en las puntuaciones NPSI entre las evaluaciones.
Se dispuso de datos sobre el dolor neuropático emergente o aumentado en relación con el abordaje quirúrgico de 60 participantes (70,6 %). Treinta y seis participantes (60,0 %) se sometieron a VATS, y 9 (25,0 %) de ellos informaron de dolor neuropático nuevo o aumentado, en comparación con 12 de 24 participantes (50,0 %) sometidos a toracotomía abierta (χ2 = 4,0, p = 0,05).
Predictores de las trayectorias del dolor
En la Tabla 4 se presentan los análisis univariantes de los predictores de la trayectoria del dolor. La edad tuvo un efecto significativo (ANOVA unidireccional: F(2,82) = 5,84, p < 0,01).
La prueba post-hoc de Tukey reveló que los participantes que seguían la trayectoria de recuperación prolongada eran más jóvenes que los del grupo de recuperación completa (diferencia media de -7,1 años, IC de 95 % (-12,4; -1,8), p < 0,01), con una tendencia similar observada en la comparación con el grupo de recuperación prolongada (diferencia media: -7,6 años, IC del 95 % (-15,6; -0,2), p = 0,06). No se observaron diferencias al comparar el grupo de recuperación completa con el de recuperación incompleta (diferencia media de 0,5 años, IC del 95 % (-0,2; 15,6), p = 0,99).
El dolor postoperatorio agudo máximo también se asoció significativamente con una trayectoria menos favorable de recuperación del dolor a los 12 meses (χ2 = 12,47, p < 0,01) (Tabla IV). Más de la mitad del grupo de recuperación incompleta (54,6 %) recibió un catéter epidural, pero no hubo diferencias significativas en la anestesia regional (p = 0,73) y el abordaje quirúrgico (p = 0,74) entre y dentro de los grupos (Tabla S3 en material suplementario).
La puntuación preoperatoria de HADS mostró un efe-cto general significativo en la trayectoria de recuperación (ANOVA unidireccional: F(2,77) = 3,29, p = 0,04). La prueba post-hoc de Tukey no reveló diferencias significativas al comparar el grupo de recuperación prolongada con el grupo de recuperación completa (diferencia media 2,0, IC del 95 % (-0,36; 4,4), p = 0,11), y al comparar el grupo de recuperación incompleta con los grupos de recuperación prolongada (diferencia media 0,8, IC del 95 % (-2,6; 4,3), p = 0,83) y completa (diferencia media 2,9, IC del 95 % (-0,4; 6,1), p = 0,10).
Las subpuntuaciones de ansiedad y depresión de HADS no mostraron un efecto significativo en la trayectoria de recuperación del dolor (ANOVA unidireccional: F(2,77) = 2,24, p < 0,11 y F(2,77) = 2,20, p < 0,12, respectivamente). Al comparar el grupo de recuperación prolongada con el grupo de recuperación completa, no se observaron diferencias en las puntuaciones parciales de ansiedad (diferencia media: 1,1; IC del 95 %: (-0,5; 2,7), p = 0,21) y depresión (diferencia media: 0,8; IC del 95 %: (-0,5; 2,0), p = 0,29). Del mismo modo, al comparar las puntuaciones parciales de ansiedad en el grupo de recuperación incompleta con los grupos de recuperación prolongada (diferencia media: 0,4; IC del 95 %: -1,9; 2,7; p = 0,89) y completa (diferencia media: 1,6; IC del 95 %: -1,9; 3,8; p = 0,21), no se observaron diferencias. Lo mismo ocurrió con las subpuntuaciones de depresión; recuperación incompleta frente a completa (diferencia media 1,3, IC del 95 % (-0,4; 3,0), p = 0,17), y recuperación incompleta frente a prolongada (diferencia media 0,5, IC del 95 % (-1,3; 2,3), p = 0,76).

OBJETO DE DISCUSIÓN
Mediante evaluaciones quincenales del dolor durante 12 meses tras la cirugía de cáncer de pulmón, este estudio identificó tres trayectorias de recuperación postoperatoria distintas y clínicamente relevantes. Un mayor dolor agudo durante las primeras 24 horas tras la cirugía se asoció con PPSP y una trayectoria de recuperación menos favorable. En el grupo de trayectoria de recuperación incompleta se observaron más síntomas de dolor neuropático, pero solo un aumento mínimo en la puntuación del inventario de síntomas de dolor neuropático.
Modelización de la trayectoria de recuperación
La mayoría de las evaluaciones del PPSP se basan en observaciones en un único punto temporal y no proporcionan información sobre la intensidad media del dolor y las fluctuaciones a lo largo del tiempo (4,8,32,33,). Según la definición actual de la IASP, cualquier dolor nuevo o intensificado que se produzca en relación con el lugar de la operación y que persista durante más de dos o tres meses debe considerarse PPSP (2). Al considerar la prevalencia de PPSP en relación con las trayectorias de recuperación pre sentadas en nuestro estudio, los hallazgos corresponden a informes anteriores, ya que la prevalencia de cualquier dolor (NRS ≥ 1) en este punto temporal fue de aproximadamente el 50 %, y del 12 % cuando se utilizó NRS ≥ 3como punto de corte. Sin embargo, esta definición estática no tiene en cuenta las fluctuaciones temporales dinámicas de la intensidad del dolor y no ofrece información sobre las trayectorias de recuperación.
Varios estudios recientes sobre trayectorias del dolor postoperatorio agudo también han investigado la transición del dolor agudo al crónico (6,18,22,23,25,34,35,36). Estos estudios calculan principalmente trayectorias basadas en observaciones frecuentes durante la hospitalización, mientras que la frecuencia de observación se reduce considerablemente tras el alta. Hasta donde sabemos, el estudio a largo plazo más detallado que emplea el método de GBTM en cirugía torácica se basó en cuatro evaluaciones tras el alta, sin distinguir entre condiciones de dolor preexistentes y PPSP (35). Otros estudios también han informado de trayectorias de recuperación a largo plazo en pacientes sometidos a toracotomía, en los que se clasificó a los pacientes en relación con el estado de recuperación en función de la puntuación NRS final (15,23). La recuperación a NRS < 1 en los grupos designados sin dolor se produjo por primera vez después de 12-24 semanas, y NRS = 0 se alcanzó por primera vez, por razones obvias, al final del seguimiento. El modelo de trayectoria presentado en nuestro estudio transmite posiblemente una imagen más precisa y relevante desde el punto de vista clínico.
Nuestra hipótesis subyacente era que podía identificarse un intervalo de tiempo específico durante la recuperación en el que las trayectorias empezaban a divergir hacia la recuperación completa o el PPSP. Las trayectorias identificadas no revelaron un intervalo de tiempo específico para la diferenciación de las vías derecuperación, pero sí demostraron que la intensidad del dolor difería significativamente entre los grupos detrayectorias durante el periodo de seguimiento de 12 meses. El modelo de trayectoria presentado es compatible con la definición actual de PPSP, ya que la recuperación completa se alcanzó en los 3 primeros meses en el grupo de recuperación completa(2). El grupo de trayectoria de recuperación prolongada sí obtuvo una remisión casi completa, con una media de NRS < 1 después de aproximadamente nueve a 12 meses, lo que indica la posibilidad de recuperación del PPSP. El modelo indicaba sólo una recuperación modesta en el mejor de los casos en caso de dolor más intenso durante las primeras semanas tras la cirugía, como se observó en el grupo de recuperación incompleta. Esto se corresponde con los hallazgos de un estudio de trayectoria similar (18), lo que implica que una atención particular al alivio y control del dolor temprano, incluidas las primeras semanas después del alta, podría ser un objetivo potencial para la prevención del PPSP, ya que la literatura actual indica que el dolor agudo es un factor de riesgo sustancial para el PPSP (4,23,32,34,37,38).
Dolor neuropático
Los síntomas de dolor neuropático crónico tras la cirugía torácica son frecuentes, con una incidencia notificada del 20 % al 30 % después de 6 a 12 meses (39,40,41,42). La extensión del daño del nervio intercostal puede ser un componente clave en el dolor neuropático postoperatorio, ya que se ha informado de menos dolor neuropático crónico después de la VATS mínimamente invasiva en comparación con la toracotomía abierta(40,42), mientras que otros no encontraron ninguna asociación con el enfoque quirúrgico (43,44). Nuestros resultados indican que el dolor neuropático emergente en relación con la zona de la operación se asoció con la toracotomía abierta y una trayectoria de recuperación menos favorable.
La intensidad del dolor neuropático, evaluada mediante NPSI, aumentó desde el inicio hasta los 6 meses en todos los grupos de trayectoria. Sin embargo, todos los grupos de trayectoria volvieron a los niveles basales de NPSI preoperatorios después de 12 meses. Se ha sugerido que los traumatismos quirúrgicos y las lesiones nerviosas no se asocian necesariamente a un aumento a largo plazo del dolor neuropático con un retorno a los niveles preoperatorios durante la recuperación (16,45). Nuestro estudio respalda estos hallazgos, aunque los resultados deben interpretarse con cautela debido al pequeño tamaño de las muestras y a la falta de datos.
Predictores de la trayectoria del dolor
El análisis exploratorio identificó la intensidad del dolor agudo como un factor predictivo de una trayectoria de recuperación menos favorable, como se había informado anteriormente en estudios de trayectoria similares (4,18,23).
La menor edad se asoció con una trayectoria de recuperación prolongada. Sin embargo, no se encontraron asociaciones significativas al comparar los grupos de recuperación completa e incompleta, lo que podría deberse al tamaño limitado de la muestra en este último. En cirugía torácica, las pruebas actuales sugieren una asociación pequeña pero significativa entre el PPSP y una edad más temprana (21). En nuestro estudio no se observaron efectos de la HADS en relación con la trayectoria de recuperación, como se había informado anteriormente en un estudio comparable (18).
Las pruebas actuales sobre la importancia de los factores psicológicos como predictores del riesgo de PPSP en cirugía torácica son contradictorias (21), pero las pruebas recopiladas en varios campos quirúrgicos indican una asociación entre los factores psicológicos preoperatorios y el riesgo de PPSP (46).
Limitaciones
El empleo del GBTM basado en datos conlleva intrínsecamente un riesgo de clasificación irrelevante y de clasificación errónea, especialmente cuando se considera una perspectiva clínica compleja. Sin embargo, el modelo de trayectoria identificado mostró trayectorias de recuperación clínicamente relevantes, basadas en numerosas observaciones dentro de cada grupo de trayectoria. Aunque las probabilidades de pertenencia a un grupo eran generalmente altas, la clasificación mediante GBTM es vulnerable a observaciones limitadas dentro de grupos más pequeños. El grupo de recuperación incompleta era relativamente pequeño, con dos participantes que mostraban una probabilidad de pertenencia inferior a la probabilidad media de > 90 %, que también se observó en tres y dos pacientes de los grupos de recuperación prolongada y completa, respectivamente.
Nuestros datos no contenían información sobre el uso de analgésicos, lo que constituye un posible factor de confusión, aunque los analgésicos estándar sólo tendrán un efecto mínimo en los pacientes con dolor neuropático. Sin embargo, los resultados de estudios anteriores muestran que los pacientes con trayectorias de dolor más elevadas utilizan más analgésicos (25,35), lo que implica que un menor dolor no puede atribuirse al uso de analgésicos, sino más bien al contrario.
Nuestro estudio presenta un modelo detallado de trayectoria de recuperación que describe la brecha entre las primeras semanas postoperatorias y la transición a la PPSP o a la remisión completa. Sin embargo, solo contiene información limitada sobre el dolor postoperatorio agudo inicial durante el ingreso. Informes anteriores indican que una trayectoria de dolor agudo inicial parece asociarse con el dolor postoperatorio después del alta, lo que implica que una imagen detallada de las trayectorias del dolor agudo y a corto plazo también es interesante en relación con el PPSP (4,23,34).
Dado que se excluyeron todos los pacientes con dolor preoperatorio, no se investigó el impacto del dolor crónico preexistente, que sería de interés, ya que los estudios existentes han informado de un mayor riesgo de PPSP en pacientes con cáncer de pulmón con dolor preoperatorio (4,18,35,47,48). El dolor crónico es común en cualquier población de pacientes, y la exclusión de los pacientes con dolor preexistente limita la aplicabilidad clínica de nuestros resultados. No obstante, este estudio presenta una imagen detallada de las trayectorias de recuperación del dolor en pacientes con cáncer de pulmón quirúrgico sin dolor preexistente, con una descripción exclusiva del dolor relacionado con la cirugía.
Nuestros resultados se basan en un seguimiento exhaustivo, pero el tamaño de la muestra sigue siendo relativamente pequeño, y el análisis de los predictores del PPSP debe interpretarse en consecuencia.
CONCLUSIÓN
Las evaluaciones quincenales del dolor durante 12 meses proporcionaron una opción única para seguir y describir las trayectorias de recuperación postoperatoria a los 12 meses. Cada trayectoria representaba una vía de recuperación específica desde el dolor postoperatorio temprano hasta la recuperación completa, la recuperación prolongada o la recuperación incompleta. Los análisis exploratorios de los factores de riesgo mostraron una asociación significativa con el dolor postoperatorio agudo y la recuperación prolongada o incompleta. Los pacientes que siguieron la trayectoria de recuperación incompleta manifestaron significativamente más síntomas de dolor neuropático, mientras que sólo se observó un pequeño aumento de la intensidad del dolor neuropático. La elaboración de perfiles de riesgo de dolor preoperatorio y la investigación de la transición del dolor posquirúrgico agudo al crónico son fundamentales para seguir investigando las intervenciones destinadas a prevenir y aliviar el PPSP.
APORTACIONES DE LOS AUTORES
AVD contribuyó a la adquisición, validación, análisis e interpretación de los datos, así como a la redacción, revisión y presentación de la versión publicada de este artículo. BD y JH aportaron su experiencia en la adquisición electrónica de datos y proporcionaron la plataforma y el diseño de la base de datos. Además, JH contribuyó a la recopilación de datos. CS incluyó a los pacientes, realizó evaluaciones preoperatorias y contribuyó a la recopilación e interpretación de datos. KD y JB contribuyeron al análisis y la interpretación de los datos, junto con aportaciones críticas a la redacción del artículo. JJA, LAN y KKP contribuyeron a la concepción y el diseño del estudio, el análisis y la interpretación de los datos, y realizaron aportaciones críticas a la redacción del artículo. Todos los autores contribuyeron a la revisión crítica y a la aprobación final del artículo publicado.
AGRADECIMIENTOS
Los autores agradecen al personal de enfermería deinvestigación y a los secretarios del Departamento de cirugía cardiotorácica del Hospital universitario de Aalborg su ayuda en la inclusión en el estudio, la recogida de datos y la validación de los mismos.
DECLARACIÓN DE CONFLICTO DE INTERESES
Los autores no tienen ningún conflicto de intereses presente o potencial que declarar en relación con el presente estudio
ORCID
A. V. Danielsen https://orcid.org/0000-0002-3025-7873
BIBLIOGRAFÍA
INFORMACIÓN COMPLEMENTARIA
Encontrará más información complementaria online en la sección Información complementaria al final de este artículo.