doi.org/10.20986/resed.2023.4042/2022
REVISIÓN
FARMACOGENÉTICA Y RESPUESTA ANALGÉSICA: HACIA UNA MEDICINA PERSONALIZADA CON ANÁLISIS DE LAS DIFERENCIAS POR SEXO
PHARMACOGENETICS IN ANALGESIC RESPONSE: TOWARDS A SEX-DIFFERENCES PERSONALIZED MEDICINE
B. Orts Jorquera1
J. Muriel Serrano2,3
A. M. Peiró Peiró1,2,3
1Servicio de Farmacología Clínica. Hospital General Universitario de Alicante, España
2Plataforma de Farmacogenética aplicada a la investigación. Grupo de Neurofarmacología aplicada al dolor, Instituto de Investigación Sanitaria y Biomédica de Alicante (ISABIAL). España
3Instituto de Bioingenería. Departamento de Farmacología Clínica, Pediatría y Química Orgánica. Universidad Miguel Hernández. Elche, Alicante, España
RESUMEN
El dolor crónico supone una epidemia silenciosa que afecta a 1 de cada 5 personas adultas en Europa. Este hecho convive con el abuso que realizan algunos pacientes de los medicamentos analgésicos, circunstancia que está limitando su prescripción en el dolor crónico no oncológico. El reto sería poder seleccionar las personas que, a priori, tendrían una mejor respuesta analgésica en base a una serie de condicionamientos intrínsecos. La presente revisión analiza las diferencias en base al sexo y a la presencia de ciertas variantes en los genes que codifican el receptor opioide mu (OPRM1), la enzima metabolizadora del citocromo CYP2D6 y la catecol-O-metiltransferasa (COMT) que degrada catecolaminas. El objetivo es suministrar potenciales elementos explicativos que puedan orientar al profesional clínico en la selección de una analgesia más personalizada.
Palabras clave: Dolor crónico, farmacogenética, OPRM1, CYP2D6, diferencias por sexo.
ABSTRACT
Chronic pain is a silent epidemic, affecting 1 in 5 adults in Europe. This fact coexists with the abuse of analgesic drugs by some patients, a circumstance that is limiting their prescription in chronic non-cancer pain. The challenge would be to be able to select the people who, a priori, would have a better analgesic response based on a series of intrinsic conditions. This review analyzes the differences based on sex and the presence of certain variants in the genes that encode the mu opioid receptor (OPRM1), the cytochrome metabolizing enzyme CYP2D6 and the catechol-O-methyltransferase (COMT) that degrades catecholamines. The objective is to provide potentially explanatory elements that can guide the clinical professional in the selection of a more personalized analgesia.
Key words: Chronic pain, pharmacogenetics, OPRM1, CYP2D6, sex-differences.
Recibido: 16-11-2022
Aceptado: 26-05-2023
Correspondencia: Beatriz Orts Jorquera
ortsjorquerabeatriz@gmail.com
LA EPIDEMIA SILENCIOSA DEL DOLOR CRÓNICO
El dolor crónico (DC) es un problema de salud mundial, subestimado por décadas, que afecta al 20 % de la población adulta (1). Más si cabe a personas de edad avanzada (2) y con una prevalencia relativamente mayor en las mujeres, según revela la encuesta publicada por Filingin y cols. y Bartley y cols., llevada a cabo en más de 85.000 adultos de 17 países alrededor del mundo (3,4). Es decir, son muchas las personas que sufren dolor hasta su nivel máximo de tolerancia y que requiere una gran cantidad de combinaciones farmacológicas para tratarlo, lo que lleva a angustia emocional y a presentar más riesgo de secundarismos farmacológicos (5,6). En general, menos de un 10 % de estos pacientes con DC es atendido en unidades especializadas, y del 60 % de los pacientes que reciben tratamiento, más de la mitad (entorno al 64 %) no consigue controlarlo (7,8), no estando satisfechos con su tratamiento (2). Por ello, se debe conseguir una mejor comprensión de los factores que condicionan la variabilidad interindividual en la respuesta analgésica, donde no sirve el modelo de “talla única” (9,10).
DIFERENCIAS DE SEXO EN EL DOLOR CRÓNICO
Entendemos por sexo como el conjunto de atributos biológicos en humanos y animales, se asocia principalmente con características físicas y fisiológicas que incluyen: cromosomas, expresión génica, niveles hormonales y anatomía reproductiva/sexual. Este suele clasificarse por femenino o masculino, aunque los atributos que lo componen pueden variar, así como su expresión (11). La evidencia de su impacto, en la prevalencia del dolor y respuesta analgésica, es variable entre países y suelen partir de datos epidemiológicos o estudios observacionales (12). Sin embargo, en España, se observa de modo sistemático que la prevalencia de DC es al menos dos veces mayor en mujeres respecto a los hombres, siendo más intenso y de mayor duración (13) entre mujeres de mediana edad (2). Todo esto puede provocar un peor estado de salud, especialmente en las personas mayores, acompañado de limitación de la movilidad u otros problemas cognitivos, como los relacionados con el sueño (14).
En este sentido, diversos estudios de investigación básica sugieren que en el caso de los animales machos las células de la microglía tendrían un papel fundamental en la aparición de alodinia e hipersensibilidad y el mantenimiento del dolor. Mientras que en las hembras las células involucradas serían los linfocitos T los involucrados en el mantenimiento del DC (15). Sin embargo, carecemos de estudios sobre el impacto de los estrógenos, que fluctúa a lo largo del ciclo menstrual, y que podría modular la respuesta al dolor (16), así como la capacidad metabolizadora hepática (17,18), que podrían implicar una menor biodisponibilidad de los opioides (19), junto con un mayor número de secundarismos farmacológicos, en mujeres (20,21,22) observados en diversos estudios descriptivos (23,24).
En el contexto de diversos estudios descriptivos sobre uso de analgésicos, se ha observado que las mujeres fueron significativamente más propensas a acumular medicamentos sin usar (68 % frente a 48 % de los hombres, p = 0,04) y a usar medicamentos adyuvantes para intentar controlar su dolor (39 % frente a 20 % de los hombres, p = 0,04), teniendo ellas más probabilidades de recibir medicamentos ansiolíticos o antidepresivos (5). En cambio, los hombres presentaron más tasas de conductas aberrantes de opioides (oxicodona, morfina), incluso en su combinación con alcohol (25). Estas diferencias de prescripción también podrían asociar a mayores interacciones farmacológicas e influir en el peor perfil de tolerabilidad farmacológica (26,27).
Obviamente, las diferencias entre sexo podrían estar significativamente influenciadas por otros factores psicosociales, como pueden ser las diferentes estrategias de afrontamiento del dolor (28). Sin embargo, parece que los roles atribuidos al género podrían contribuir a las diferencias en la expresión del dolor (signos y síntomas) que asociarían diferencias en el manejo del dolor (diagnósticas, terapéuticas) (24) y que si los tuviéramos en cuenta, podría mejorar la equidad del sistema sanitario (19,29,30,31). A esta situación se suma la crisis debida al consumo de opioides con fines no médicos que fue decretada hace menos de cinco años y que está cambiando el panorama de uso de dichos medicamentos en el entorno del paciente no oncológico (32). Se considera que ambos sexos tienen idéntico riesgo, sin embargo, algunos estudios señalan que el riesgo podría ser mayor en las mujeres por razones relacionadas con las características del dolor (33), comorbilidad (25,34) o por el mayor acceso a los opioides de prescripción (35). Por todo ello, la interrelación e integración del sexo, como marcador biológico, al género como indicador de comportamiento (36), podría mejorar la efectividad y eficiencia de los programas comunitarios (16,37). Significa que debemos desarrollar las herramientas de investigación necesarias para estar en condiciones de detectar los factores que ponen a las mujeres y los hombres en un riesgo diferencial y abordarlos con intervenciones eficaces (38).
GENES CANDIDATOS A ESTUDIO EN LA RESPUESTA FARMACOLÓGICA
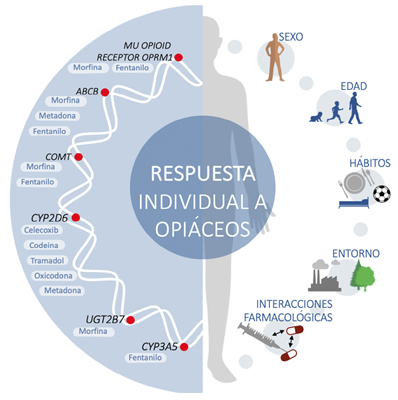
Una de las ciencias que estudia este tipo de variaciones es la farmacogenética. Esta disciplina estudia cómo son las interacciones entre un fármaco y un individuo concreto en relación con las diferencias en el ADN, como un factor más explicativo de las diferencias interindividuales. Estas diferencias genéticas individuales en los receptores, junto con distinta idiosincrasia personal, condicionan una repuesta individual a los opiáceos, tal y como muestra la Figura 1. En ella se aprecian diferencias por aspectos, como son el ambiente o la dieta, pero también hay diferencias en cuanto a sistemas metabólicos diferentes, por lo tanto, potenciales interacciones farmacológicas sujetas a polimorfismos genéticos que pueden generar una respuesta variable entre individuos y riesgo de toxicidad, o falta de control del dolor. También podría ser diferente para cada opioide la producción de metabolitos, tanto activos como tóxicos, con las repercusiones a que pueden dar lugar, positivas o negativas, en cada paciente. Tal es así, que en los últimos años los marcadores genéticos se consideran un aspecto clave durante las fases de ensayo de los nuevos medicamentos y a la hora de su aprobación regulatoria (39,40). Cabe destacar que gran parte de esta información se obtiene de estudios observacionales caso-control, por lo que se requieren ensayos clínicos que muestren su utilidad, según la patología y el medicamento (41,42,43).
Elaboración propia.

Fig. 1. Factores que modulan la respuesta individual a los medicamentos analgésicos opioides.
Por lo tanto, se realizó una revisión narrativa de la literatura por pares seleccionado los trabajos según, el resumen y la evaluación de la calidad de los manuscritos de julio a diciembre de 2022. Se supervisó de forma independiente los procesos de precisión y calidad de cada uno (Medline, base de datos PubMed) con las siguientes palabras clave: 1) farmacogenética, 2) tratamiento farmacológico con opioides, 3) dolor crónico y 4) terapia analgésica coadyuvante. A partir de esta consulta, los resultados de ambos autores se superpusieron en 27 manuscritos, donde 3 ya no eran candidatos por no estar escritos en inglés. Finalmente, después de revisiones adicionales, 24 artículos fueron seleccionados de forma independiente y conjunta entre los autores. Además, el resto de las referencias incluidas en este trabajo provienen de la verificación de listas de referencias de manuscritos seleccionados y relevantes para posibles estudios elegibles.
Genes con información accionable en la analgesia
Los genes que cuentan con una mayor traslación clínica en el tratamiento del dolor, según las recomendaciones de las Agencias Reguladoras y Consorcios Internacionales, se detallan en la Tabla 1 (44).
Entre ellos destacan los genes que codifican los receptores opioides, a través de cuya activación se produce la analgesia, siendo el principal el receptor opioide mu (gen OPRM1), y en menor medida los delta (gen OPRD1) y kappa (gen OPRK). Por otra parte, se encuentran los genes implicados en el metabolismo y/o eliminación de los opioides, entre ellos los de la familia de enzimas CYP450 (mayoritariamente CYP2D6 y/o CYP3A4), o los relacionados con la vía metabólica de la glucuronidación catalizada por la UDP-glucuronosyltransferasa (UGT2B7). De igual forma, se ha estudiado el efecto del gen que codifica la enzima catecol-O-metiltransferasa (gen COMT), implicada en la degradación de catecolaminas y modulación del dolor; así como las variantes en el gen que codifica la glicoproteína-p (gen ABCB1/MDR1), las cuales podrían influir en el transporte y disponibilidad del fármaco opioide (45,46,47). Sin embargo, no hay datos suficientes para hacer recomendaciones sobre su uso generalizado, existiendo muy poca información sobre el impacto de otras variables intrínsecas, como puede ser el sexo, en la respuesta farmacológica mediada por la genética (48).
Tabla I. Marcadores farmacogenéticos implicados en la variabilidad interindividual a la respuesta de los analgésicos opioides.
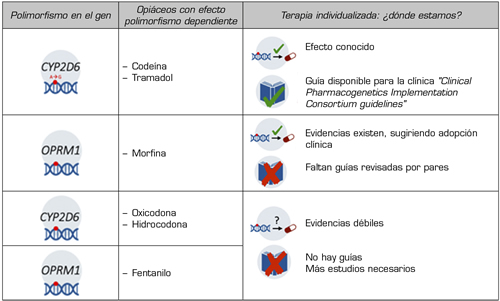
Elaboración propia con Biorender.
Gen del receptor opioide mu (OPRM1)
Los medicamentos analgésicos ejercen su acción principalmente a través de la activación del receptor OPRM1, que presenta más de 100 variantes genéticas siendo la más conocida, la A118G (rs1799971). Esta conduce a una sustitución de asparagina por aspartato en el aminoácido 40 (Asn40Asp), con una frecuencia de la variante alélica que varía desde el 2 % en poblaciones africanas hasta superiores al 50 % en asiáticas. De hecho, la proteína variante exhibe afinidad de unión tres veces mayor por la endopéptido β-endorfina, con una respuesta analgésica reducida al fentanilo y la morfina-6-glucurónido. En un estudio observacional realizado en mujeres y hombres con DC postoperatorio, el genotipo GG requirió dosis medias más altas de morfina, a las 24 horas, para aliviar el dolor (22,3 ± 10,0 mg) en comparación con los alelos wild type AA (16,0 ± 8,0 mg) y el mutante heterocigoto AG (14,8 ± 7,1 mg) así como a las 48 h (GG, 40,4 ± 22,1 mg; AA, 25,3 ± 15,5 mg; AG, 25,6 ± 11,7 mg) (49).
Estudios en animales mostraron diferencias en la reducción específica por sexo en las propiedades gratificantes de la morfina y los componentes aversivos de la abstinencia a morfina, precipitada por naloxona, entre animales macho y hembra (50), según el genotipo OPRM1. De forma similar, otro estudio sugirió una influencia sexual en la regulación epigenética del OPRM1, que podría contribuir a diferencias en la tolerancia inducida por opioides, la analgesia y la dependencia física entre ratones macho y hembras (51). Más si cabe, estudios con oxicodona sugieren que el alelo G promueve una mayor ingesta de opioides, lo que puede ser la base de una mayor morbilidad por adicción a los opioides en los portadores del alelo G, tanto en machos como en hembras (52).
Interacción OPRM con el gen catecol-O-metiltransferasa (COMT)
La enzima COMT se encarga de la degradación de catecolaminas, siendo un modulador clave de la neurotransmisión dopaminérgica y adrenérgica, y, como consecuencia, en la respuesta de señalización de recompensa a los opioides. En este caso, la variante genética G472A (rs4680), causa una sustitución de valina por metionina en el codón 158 de la enzima (Val158Met). Esto genera una enzima que es hasta cuatro veces menos activa, que la original, con un requerimiento menor de morfina, sobre todo cuando se combina con el genotipo OPRM1-AA (SNP A118G). Este hecho se pudo determinar, como describen Reyes-Gibby y cols. en un estudio observacional realizado en 207 pacientes, hombres y mujeres, de origen caucásico en tratamiento de dolor oncológico (53). Además, varios trabajos muestran que el estrés y el sexo pueden afectar a la sensibilidad al dolor dependiente de COMT debido a sus efectos sobre el sistema adrenérgico al modificar la carga de epinefrina que puede resultar en un aumento de la sensibilidad al dolor (54) en voluntarios sanos.
Gen del citocromo CYP2D6
El metabolismo de los fármacos analgésicos puede comprender reacciones de conjugación con metabolitos más fáciles de excretar por vía renal o hepática, como en el caso de la morfina y el fentanilo; o reacciones de oxidación, reducción o hidrólisis, donde suelen participar las enzimas del citocromo P450, principalmente las enzimas CYP3A4 y CYP2D6, como en el caso del tramadol y de la oxicodona (55). La vía metabólica cobra especial relevancia al ser frecuente el uso concomitante con otros fármacos uso concomitante de medicamentos inhibidores de la enzima CYP (por ejemplo, paroxetina, fluoxetina, bupropión) o inductores (por ejemplo, carbamazepina, fenobarbital y fenitoína), con las consiguientes fluctuaciones de las concentraciones plasmáticas de los analgésicos (56). Estos factores junto con el alto nivel de polimorfismo CYP2D6 implican una alta modulabilidad de esta enzima, se postula como principal causa de las diferencias observadas en la práctica clínica y que han sido recogidos en estudios, sobre todo, observacionales y descriptivos (Tabla 2).
Tabla II. Listado de fármacos que actúan como inductores, inhibidores y sustratos del CYP2D6.
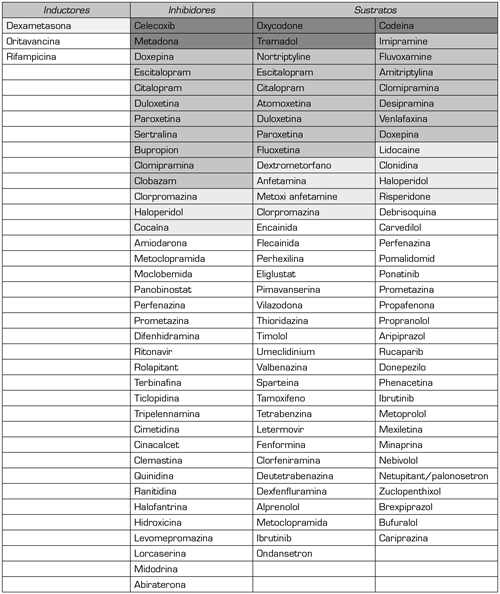
Sombreados en gris oscuro: analgésicos; en gris intermedio: antidepresivos y ansiolíticos; en gris claro: medicamentos coadyuvantes; en blanco: miscelánea.
De este modo, las variantes del gen CYP2D6 pueden incrementar o disminuir su actividad enzimática y, por tanto, su capacidad metabolizadora (57,58). Un estudio observacional de casos con dolor crónico no oncológico y controles, realizado en 1000 pacientes distribuidos por diferentes países de la Unión Europea, ha revelado que la prescripción guiada de oxicodona en metabolizadores CYP2D6 lentos mejora la analgesia, con un menor requerimiento de dosis de opioides, y con menos efectos secundarios en los metabolizadores CYP2D6 ultrarrápidos (59,60,61) (Tabla 3).
Tabla III. Influencia del fenotipo CYP2D6 sobre la Oxicodona y otros resultados farmacológicos de opioides, en relación con la dosis requerida, el metabolismo o los efectos secundarios durante el tratamiento.
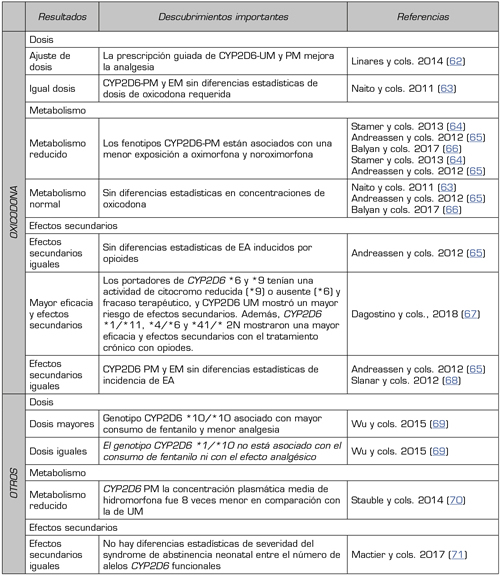
PM: metabolizador pobre o lento. EM: extensivo metabolizador. UM: ultrarrápido metabolizador. EA: evento adverso.
Elaboración propia mediante revisión de artículos.
No obstante, además de la configuración genotípica, la actividad de la enzima CYP2D6 está regulada por un gran número de factores fisiológicos (ciclo menstrual, embarazo, entre otros) patológicos (enfermedad hepática, inflamación, entre otros) o ambientales (tabaco, alcohol, entre otros) (56). Además, algunos factores epigenéticos (metilación del ADN y modificaciones de histonas) pueden influir en la expresión del CYP2D6, y por tanto modificar la actividad de la enzima y los fenotipos sin que exista una alteración en la secuencia de ADN. Pese a que la evidencia clínica es limitada, se ha observado que el efecto combinado de inhibir la metilación del ADN y la desacetilación de las histonas en células madre embrionarias produciría un aumento de la expresión del gen CYP2D6 y por tanto de su funcionalidad (72).
FARMACOGENÉTICA APLICADA A LOS MEDICAMENTOS ANALGÉSICOS
Tramadol
Uno de los analgésicos más prescritos a día de hoy es el tramadol, un agonista OPRM1, que además inhibe la recaptación de noradrenalina y serotonina. Farmacológicamente es un profármaco que se convierte en la molécula activa por acción de la enzima hepática CYP2D6. Es por ello que la presencia de variantes genéticas en el CYP2D6 puede conducir a una alteración de la función metabólica y la pérdida de eficacia o el aumento de toxicidad (estreñimiento, boca seca, dolor de cabeza, sudoración, entre otros) por lo que se recomienda su implementación clínica en base a un buen número de estudios de calidad con diseños robustos (44).
Como en el resto de opioides, el tramadol se ha asociado en los últimos años a casos de abuso y dependencia (73). En estudios realizados en países escandinavos, se refleja una mayor prescripción en mujeres y en personas de mayor edad (74). El abuso en este colectivo, debido a que no siguen los estereotipos de persona con potencial uso aberrante de opioides podría pasar inadvertido en la práctica asistencial. En otro contexto, la Agencia Mundial Antidopaje decidió incluir el tramadol en su Programa de Monitorización de 2012 diseñado para monitorizar y detectar patrones de uso indebido de sustancias no incluidas en la lista de prohibidos. En este sentido, se ha alertado sobre su uso en base a la facilidad con la que se adquiere, su menor precio y la noción, especialmente entre los jóvenes y deportistas, de que al ser un medicamento, es menos peligroso (75).
Tapentadol
Es un agonista opioide que a su vez presenta inhibición de la recaptación de norepinefrina, desarrollado para reducir los eventos gastrointestinales (76). Se metaboliza en el hígado mediante conjugación de fase II, predominantemente por glucuronidación vía UGT2B7 y reacciones de oxidación de fase I a través de la CYP2D6 metabolitos sin actividad farmacológica (77).
La relevancia de las posibles fluctuaciones en las concentraciones de este fármaco no reside tanto en el sexo, puesto que no existen recomendaciones farmacogenéticas en la prescripción del mismo, sino más bien en la prevalencia de su prescripción. Así lo revela un estudio descriptivo en más de 1800 pacientes en Atención Primaria, donde se muestra que la prescripción junto con otros opioides es frecuente, puesto que sucedía entre el 85-89 % de los pacientes (78). En cualquier caso, en estudios propios observacionales retrospectivos, se ha detectado que las mujeres reciben una menor dosis media de opiodes mayores, incluyendo tapentadol (79).
Oxicodona
Se metaboliza principalmente a través la enzima CYP3A4 a noroxicodona, y también por la CYP2D6 originando oximorfona, que tienen una pequeña contribución a sus efectos analgésicos pero que su acumulación se ha asociado, en diversos casos clínicos, con una mayor toxicidad incrementando los niveles de oxicodona en orina (80).
Morfina y fentanilo
En el caso de otros opioides ampliamente empleados en la medicina del dolor como es el caso de la morfina, además de poseer actividad farmacológica por sí misma, genera, por glucuronidación, 2 metabolitos diferentes: mofina-6-glucurónido y morfina-3-glucurónido principalmente a través de la enzima UGT2B7, y aunque existe cierta evidencia que sugiere asociaciones entre la configuración genética y su farmacocinética, su implementación clínica no se ha establecido, siendo usado a título informativo. Una situación similar presenta el fentanilo. Se trata de un potente analgésico metabolizado por la enzima CYP3A4 a norfentanilo, un metabolito inactivo. En su caso, no existe un consenso sobre un uso clínico que incorpore marcadores farmacogenéticos (55). No obstante en algunos estudios (Tabla 3) refieren que algunos genotipos como el CYP2D6 *10/*10 asocian un mayor consumo de fentanilo y menor analgesia.
CONCLUSIÓN
La analgesia personalizada presagia un nuevo enfoque farmacológico para el manejo del dolor con opioides, donde los marcadores farmacogenéticos pueden ser útiles como predictores de respuesta. Es por ello que deberían indagarse estrategias de genotipado anticipado, sobre todo, en relación al CYP2D6. Por otro lado, existen diferencias entre la fisiología de un hombre y de una mujer que podrían influir en la percepción del dolor o en la respuesta farmacológica, que podrían comenzar a registrarse (diferencias en el peso, perfil hormonal) así como analizar las causas del mayor uso de psicotropos en las mujeres frente a los hombres o del perfil de seguridad farmacológico distinto según el sexo. Esto contribuiría no solo a implementar la Medicina de Precisión en el manejo del dolor, sino a abrir la puerta una farmacología con perspectiva de género.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FUENTE DE FINANCIACIÓN
No se ha percibido financiación económica específica para la realización de la investigación y/o la preparación del artículo.
BIBLIOGRAFÍA