
DOI: 10.20986/resed.2020.3814/2020
ARTÍCULO ESPECIAL
Fisiopatología clínica en pacientes con enfermedad de células falciformes: la transición del dolor agudo al crónico
Clinical pathophysiology in patients with sickle cell disease: the transition from acute to chronic pain
B. Mugabure Bujedo1,2
S. González Santos1
A. Uría Azpiazu1
A. Osorio López1,3
1Departamento de Anestesiología, Cuidados Críticos y Medicina del Dolor Perioperatoria. Hospital Universitario de Donostia. San Sebastián, España
2Unidad del Dolor, Manejo del Dolor Crónico. Hospital Universitario de Donostia. San Sebastián, España
3MIR Anestesiología. Hospital Universitario de Donostia. San Sebastián, España
RESUMEN
Los pacientes con enfermedad de células falciformes (ECF), también denominada drepanocítica, sufren un dolor intenso que suele comenzar durante la infancia y aumenta su gravedad a lo largo de la vida, lo que lleva a la hospitalización y a una mala calidad de vida a lo largo de los años. Una característica única de la ECF son las crisis vaso-oclusivas (CVO), caracterizadas por episodios recurrentes e impredecibles de dolor agudo. La obstrucción microvascular durante una CVO provoca una disminución del suministro de oxígeno a la periferia y una lesión por isquemia y posterior reperfusión, inflamación, estrés oxidativo y disfunción endotelial, todo lo cual puede perpetuar un microambiente nocivo que provoca dolor. Por otro lado, además de los dolores agudos episódicos, los pacientes con ECF también padecen dolor crónico, definido como dolor casi diario durante un periodo de 6 meses, asociado a trastornos psicosociales. Pueden deberse a lesiones crónicas como úlceras cutáneas, necrosis avascular ósea o infartos en diversos órganos. Asimismo, la sensibilización central parece estar directamente involucrada en la cronicidad del dolor y existe un componente de dolor neuropático claramente infradiagnosticado e infratratado. El tratamiento actual del dolor moderado a intenso en la ECF se basa principalmente en la administración de los opioides, vía oral, de liberación rápida ambulatoria o en forma de analgesia controlada por el paciente vía intravenosa intrahospitalaria. Sin embargo, el uso de opioides a largo plazo está asociado con múltiples efectos secundarios. Esta revisión presenta los últimos avances en la comprensión de la fisiopatología del dolor en la ECF y se describen los mecanismos subyacentes que pueden ayudar a desarrollar nuevas estrategias terapéuticas y/o preventivas para mejorar el dolor en la ECF.
Palabras clave: Analgesia, enfermedad de células falciformes, dolor agudo, síndrome de dolor crónico, opioides
ABSTRACT
Patients with sickle cell disease (SCD) suffer from severe pain that often begins in childhood and increases in severity over the course of a lifetime, leading to hospitalization and poor quality of life over the years. A unique feature of SCD is vase-occlusive crises (VOC) characterized by recurrent and unpredictable episodes of acute pain. Microvascular occlusion during a VOC results in decreased oxygen supply to the periphery and injury from ischemia and subsequent reperfusion, inflammation, oxidative stress and endothelial dysfunction, all of which can perpetuate a harmful pain-causing microenvironment. On the other hand, in addition to episodic acute pain, SCD patients also report chronic pain, defined as almost daily pain over a 6-month period associated to either sicologic or social morbidities. They may be due to chronic lesions such as skin ulcers, avascular bone necrosis or infarctions in various organs. In addition, central sensitization appears to be directly involved in the chronicity of pain and there is a clearly under-diagnosed and under-treated component of neuropathic pain. Current treatment of moderate to severe pain in SCD is based primarily on opioids; either as an oral quick release outpatient or in the form of patient-controlled intravenous analgesia in the hospital. However, long-term opioid use is associated with multiple side effects. This review presents the latest advances in the understanding of the pathology of pain in SCD and describes objectives based on mechanisms that may help to develop new therapeutic and/or preventive strategies to improve pain in SCD.
Key words: Analgesia, sickle cell disease, acute pain, chronic pain syndrome, opioids
Correspondencia: Borja Mugabure Bujedo
mugabure@yahoo.es
Recibido: 17-04-2020
Aceptado: 07-07-2020
INTRODUCCIÓN
La enfermedad de células falciformes (ECF) es un trastorno de la hemoglobina, de herencia autosómica recesiva, caracterizado por mutaciones homocigóticas o heterocigóticas compuestas en los genes de la beta-globina. La sustitución del ácido glutámico por valina en la posición 6 genera una hemoglobina anómala denominada HB S (1). Afecta aproximadamente a 100.000 personas en los Estados Unidos y a 25 millones de personas en todo el mundo, con preferencia por la población afroamericana (2,3). Las crisis vasoclusivas son una de las manifestaciones características de la enfermedad y provocan frecuentes visitas a los servicios de urgencias e ingresos hospitalarios, lo que se calcula que supone un coste anual de 2400 millones de dólares en los Estados Unidos (4). La evidencia sobre los patrones de uso de opioides en esta población de pacientes es bastante limitada, y todavía existe controversia sobre la dosis de opioides que los pacientes con ECF usan en su vida diaria. Muchos creen que los pacientes tienden a usar más opioides que muchas otras condiciones de dolor crónico, mientras que algunos estudios mostraron una dosis de opioides relativamente baja usada en esta población de pacientes (5,6).
La frecuencia y la gravedad del dolor de la ECF aumenta con la edad, y un subconjunto de niños desarrolla un síndrome de dolor crónico en la adolescencia y la edad adulta, además de episodios de dolor agudo recurrente. Se ha informado que el 30-40 % de los adolescentes y adultos con ECF padecen dolor crónico diario (7,8) y los episodios continuos de dolor agudo se superponen al dolor crónico, todo lo cual afecta gravemente a la calidad de vida relacionada con la salud (9,10). Estos sujetos presentan una expectativa de vida alrededor de 50 años debido a complicaciones graves, como el síndrome torácico agudo, infartos en huesos largos y en diversos órganos como el riñón, así como infecciones secundarias a bacterias encapsuladas como el Streptococcus pneumoniae, por lo que las vacunas correspondientes y los tratamientos antibióticos profilácticos son vitales. La hidroxiurea (HU) y la L-glutamina están aprobadas por la Food and Drugs Administration (FDA) y son medicamentos modificadores de la enfermedad para la prevención de los episodios de dolor agudo. La HU ha demostrado una capacidad protectora en la ECF, debido al aumento producido en la HbF (hemoglobina fetal) mediante la reducción de la enzima ribonucleótido reductasa, mejorando hasta en un 50 % las CVO (11,12). A pesar de la significativa morbilidad que el dolor causa en las personas con ECF, la biología subyacente del dolor, que produce tanto agudo como crónico, no está definida completamente.
Clásicamente, el dolor de la ECF se ha atribuido al dolor nociceptivo o inflamatorio resultante de la oclusión vascular repetida inducida por los glóbulos rojos falciformes, la lesión crónica de isquemia-reperfusión y la inflamación subsiguiente (13,14). Sin embargo, en la actualidad se entiende que el dolor de la ECF es muy complejo, multifactorial y variable, lo que da lugar a un dolor nociceptivo, inflamatorio y neuropático. Las personas con ECF a menudo informan de un dolor crónico significativo (7,8) en múltiples lugares del cuerpo (15) que no se puede atribuir a una causa identificable o a una lesión tisular como la necrosis avascular ósea, las úlceras de la pierna o micro embolias (16). Además, a pesar de que los opioides y los antinflamatorios no esteroideos son la columna vertebral del tratamiento del dolor de la enfermedad, a menudo son ineficaces y solo consiguen un alivio parcial del dolor. Este patrón de dolor presenta unos desafíos clínicos del abordaje del tratamiento que han llevado a la investigación de vías alternativas en la etiología del dolor que están fuera de la anormalidad de los glóbulos rojos. Es importante resaltar que muchas de estas investigaciones se han centrado en la contribución de las anomalías en el sistema nervioso central y periférico al dolor junto con mecanismos alterados en las vías de transmisión del dolor. Debido a estas investigaciones, la sensibilización central ha surgido como uno de los componentes subyacentes de la experiencia del dolor en la ECF. Es muy posible que el dolor crónico en este caso se asocie a la activación de las células de la glía y a la liberación de mediadores inflamatorios en el Sistema Nervioso Central (SNC).
Para intentar aclarar estas dudas, en esta revisión narrativa se realizó una búsqueda en Ovid, Medline, Embase y Cochrane Database para identificar todos los artículos publicados hasta mayo de 2020, utilizando las palabras clave analgesia, enfermedad de células falciformes, dolor agudo, síndrome de dolor crónico y opioides. Para la ECF se han recopilado revisiones sistemáticas o narrativas, metanálisis o revisiones Cochrane. Para los agentes analgésicos que no se han sometido a una combinación de datos tan sistemática se valoraron individualmente para realizar una revisión narrativa. Para la fisiopatología del dolor se obtuvieron los estudios pertinentes a través de una búsqueda en Ovid y Medline y se revisaron individualmente para identificar cualquier estudio que pudiera haberse perdido en la búsqueda principal. Se recuperó material adicional mediante la revisión manual de referencias de artículos relevantes identificados con mayor nivel de impacto y citas previas. Todas las citas bibliográficas finalmente incluidas se eligieron por los autores con el fin de conseguir enfocar la revisión en los términos previstos.
FISIOPATOLOGÍA
Circuitos de transmisión del dolor
Se sabe que la neurobiología del dolor implica la transducción, la transmisión, la modulación y la percepción del dolor a través de los sistemas somatosensorial y límbico (17,18). El primer paso es la conversión de un estímulo nocivo (incluidos los agentes mecánicos, químicos, térmicos y otros agentes algógenos) en un impulso nervioso eléctrico en forma de un potencial de acción. Este último se genera por la afluencia de iones cargados positivamente en un axón a través de canales de sodio voltaje dependientes que circulan a través de la membrana neuronal. Los potenciales de acción se propagan a través de las fibras nerviosas aferentes primarias cuyos cuerpos celulares situados en el ganglio de la raíz dorsal de la médula espinal (GRD) se conectan con neuronas de segundo orden en el cuerno dorsal del asta posterior medular. Las neuronas de segundo orden responden a las entradas nociceptivas de las fibras A-d y C, y a las entradas no nociceptivas de las fibras A-b. Las fibras A-d responden a los estímulos mecánicos y térmicos y son responsables del dolor agudo, como el que tal vez evoca una CVO. Estas fibras activan instantáneamente las neuronas de segundo orden. Las fibras C responden a una amplia gama de estímulos, incluidos los térmicos, mecánicos y químicos que producen un dolor sordo lento y duradero, y activan las neuronas de segundo orden al mantener el estado de despolarización durante un largo período de tiempo. Las fibras de A-b transmiten la sensación de tacto y también la propiocepción, son receptores polimodales de bajo umbral. Por ello, la activación de estas fibras puede suprimir el dolor (como el masaje de una zona dolorosa para aliviar el dolor), y son fundamentales para regular la puerta de entrada a nivel del GRD, según la teoría de la Puerta de entrada de Melzack y Wall descrita en 1965. Es, por tanto, tan importante la llegada de información a través de las aferencias primarias nociceptivas como no nociceptivas (19).
Las neuronas de segundo orden del asta dorsal de la médula permiten la transmisión de la sensación nociceptiva o de la sensación táctil al cerebro. Estas neuronas son activadas por el glutamato y la sustancia P (SP). El cuerno dorsal espinal actúa como una “puerta” para la convergencia entre las fibras de la periferia y las fibras descendentes de los centros cerebrales superiores. Los impulsos transmitidos desde la periferia a este locus pueden ser modulados por las entradas de las fibras neuronales descendentes, así como por las grandes fibras A-b, tras una compleja interacción con los neurotransmisores excitadores e inhibidores y las interneuronas GABAérgicas. Finalmente, el sistema descendente de modulación del dolor que se origina en los centros superiores del cerebro desempeña un papel fundamental en la percepción de la señal aferente al inhibir o amplificar las entradas nociceptivas a través de los neurotransmisores serotonina, dopamina, opiáceos endógenos, g ácido gamma-amino butírico, glicina y otros. Las señales moduladas se procesan en las áreas del cerebro responsables de la percepción sensorial y de la estimulación del afecto, la emoción y la memoria. La naturaleza y la gravedad de la percepción consciente del dolor dependen del complejo procesamiento en diferentes áreas del cerebro, incluyendo la corteza somato sensorial, la corteza prefrontal, la amígdala y la corteza cingular anterior. Recientemente, la atención se ha centrado en los componentes de la nocicepción basados en la percepción debido a su capacidad para reducir el dolor mediante técnicas conductuales no farmacológicas, como la imaginería guiada, la capacitación en atención y relajación, la hipnosis y la terapia conductual cognitiva (20).
Alteraciones descritas en la ECF
La enfermedad de células falciformes abarca desde una mutación puntual a una disfunción sistémica y dolor. La circulación de los glóbulos rojos falciformes conduce a múltiples problemas fisiopatológicos, incluyendo, pero no limitado, a hemólisis, hipoxia/reperfusión, isquemia, inflamación excesiva y hemoglobina libre, por rotura de hematíes, disfunción vascular, daño a órganos y oclusión vascular. Cada una de ellas puede contribuir a un microambiente nocivo que evoca los mecanismos nociceptivos del dolor. Los datos emergentes han identificado varias dianas celulares y moleculares que contribuyen a la actividad nociceptiva en la anemia drepanocítica. Estas dianas pueden estar situadas en la periferia y/o en el SNC, lo que sugiere que el microambiente por el daño celular y/o tisular generado a consecuencia de la ECF puede activar la transmisión del dolor desde la periferia e influir directamente en el SNC. Los mecanismos de nocicepción son complejos, ya que implican la actividad neural periférica y central que implica varios procesos diferentes (13):
Finalmente, puede producirse una sensibilización periférica y/o central en respuesta a los estímulos nociceptivos en curso, lo que da lugar a una reducción del potencial del umbral de disparo que conduce a la generación de dolor con estímulos inocuos (alodinia). Los impulsos nerviosos viajan ortodrómicamente desde la periferia hasta la médula espinal, pero bajo una activación sostenida, tanto por la duración como por la intensidad del estímulo, pueden viajar en sentido antidrómico, liberando neurotransmisores como la Sustancia P (SP) en la periferia condicionando la aparición de hiperalgesia secundaria. Además, la liberación de neuropéptidos excitadores también puede ocurrir en la periferia a partir de terminaciones nerviosas axonales activadas por reflejo axonal, lo que favorece la sensibilización nociceptiva (22). Debido a la naturaleza genética de la ECF, un microambiente nocivo repleto de factores algógenos puede inducir los mecanismos nociceptivos durante la infancia y mantener la activación hasta la edad adulta si la enfermedad permanece sin control, lo que da lugar a una sensibilización periférica y central que da lugar a un dolor crónico refractario a la terapia clásica. Por ello, recientemente, la atención se ha centrado en los componentes del dolor basados en la percepción debido a su capacidad para reducir el dolor mediante técnicas conductuales no farmacológicas, como la terapia con imágenes, el entrenamiento en atención (mindfulness) y relajación, la hipnosis y la terapia conductual cognitiva (23).
Inflamación neurógena
Las fibras C activadas liberan neuropéptidos vasoactivos y proinflamatorios, incluyendo SP y el péptido relacionado con el gen de la calcitonina (CGRP), que estimulan la vasodilatación arteriolar y la fuga vascular. Pero, además, se liberan mediadores inflamatorios, desde las células inmunológicas presentes en la zona alterada, desde las células endoteliales y las propias células de Schwann, y finalmente desde las células tisulares, que contribuyen a generar la inflamación neurógena. La SP y el CGRP transportados ortodrómicamente a las neuronas de segundo orden también contribuyen a la sensibilización central y conducen a la sensibilización periférica al ser liberados antidrómicamente a las fibras nerviosas periféricas. Estos neuropéptidos vasoactivos y proinflamatorios pueden promover la disfunción -vascular al aumentar la permeabilidad vascular, así como la activación de los nociceptores periféricos, contribuyendo así a múltiples características de la ECF, entre ellas la dactilitis y el dolor. Dado que la capacidad de los agentes antinflamatorios estándar para mejorar la inflamación neurógena y el dolor resultante es limitada, es probable que sea necesario desarrollar y probar en la ECF nuevos agentes farmacológicos que se dirijan específicamente a esta vía. Este hecho es una tendencia general en una gran cantidad de enfermedades refractarias a la utilización de fármacos tradicionales y sistémicos. Por ello se abren líneas terapéuticas que estudian básicamente los tratamientos reguladores de los procesos inflamatorios locales (24,25).
Sensibilización central
El dolor crónico de la ECF es una entidad fisiopatológica distinta al dolor en los episodios agudos porque el origen inicial de la lesión suele no ser relevante una vez que las vías sensoriales pasan a un estado de hiperexcitabilidad. Este proceso de cronificación del dolor comienza con una sensibilización periférica de los nociceptores mediante la activación de los canales iónicos por las sustancias proinflamatorias, activando los canales de los receptores vanilloide 1 (VRPT1) y de sodio (Na+), y el posterior deterioro del control inhibitorio descendente mediado por las interneuronas inhibidoras (la muerte interneuronal está asociada al proceso de excitotoxicidad mediado por las denominadas neuronas oscuras), lo que modifica el equilibrio hacia un estado de hiperexcitabilidad neuronal. Dicha hiperexcitabilidad comprende una mayor sensibilidad a los estímulos nocivos de baja intensidad (hiperalgesia) o incluso frente a estímulos no dolorosos (alodinia). En ambos casos, como se observa en laboratorio con los ratones con rasgos falciformes, las respuestas son percibidas como estímulos dolorosos de alta intensidad (26,27,28).
En relación a lo anteriormente expuesto, los registros electrofisiológicos en un modelo transgénico de ratones falciformes (BERK) revelaron un aumento de la excitabilidad de las neuronas nociceptivas del asta dorsal de la médula espinal, demostrado por el aumento en los campos receptivos, la tasa exagerada de actividad espontánea, el aumento de la capacidad de respuesta y la prolongación de las descargas posteriores al estímulo mecánico (fenómeno de sumación temporal), y un umbral mecánico más bajo en comparación con los controles de BERK (29). Se observó la activación de vías de señalización implicadas en la hiperexcitabilidad neuronal, incluidas las proteínas quinasas activadas por mitógenos, la c-jun quinasa, la p42/p44 cinasa del receptor extracelular y la p38, así como el transductor de señales y el activador de la transcripción 3, en las médulas espinales de los ratones falciformes. También encontraron oxígeno reactivo elevado (ROS), SP, y células microgliales y astrocíticas activadas con un aumento de la proteína fibrilar ácida glial (GFAP) en el cuerno dorsal de la médula espinal de los ratones falciformes (30). En estudios humanos, se informó de una mayor circulación de GFAP en los niños con ECF en comparación con los controles. Por lo tanto, el aumento del estrés oxidativo y las interacciones neuroinmunes pueden contribuir a la hiperexcitabilidad neuronal y el dolor crónico, vías que pueden proporcionar dianas para estrategias terapéuticas novedosas (31).
En los pacientes con ECF, las pruebas sensoriales cuantitativas (QST) demostraron una mayor sensibilidad a los estímulos mecánicos y térmicos (calor y frío), lo que sugiere una sensibilización central (32,33,34). Los estudios de neuroimagen en pacientes con ECF mostraron una mayor conectividad pronociceptiva y una menor conectividad antinociceptiva en el modo de red predeterminado (“default mode network” [DMN]) de los pacientes con estancias de hospitalización más prolongadas relacionadas con el dolor, en comparación con los que tuvieron estancias más cortas (35). Las grabaciones de electroencelografía realizadas simultáneamente con las imágenes de resonancia magnética funcional realizadas en pacientes con ECF aclararon las manifestaciones neurofisiológicas de las redes en etapa de reposo, incluida la DMN. Se observó una mayor actividad de electroencelografía en los pacientes durante el reposo en las regiones de procesamiento del dolor, lo que concuerda con los hallazgos de las imágenes de resonancia magnética funcional de la reducción de la actividad de la DMN y el aumento de la actividad en las regiones de procesamiento del dolor en comparación con los sujetos de control. De acuerdo con conclusiones anteriores, se demostró una reducción significativa de los vóxeles en los pacientes con ECF en la región de la red de control ejecutivo que participan en las funciones cognitivas, incluidas la percepción y la toma de decisiones. Se ha observado una función cognitiva deficiente y alteraciones en la red de control ejecutivo en pacientes con ECF (36,37).
Así pues, las observaciones realizadas en ratones falciformes y en pacientes con ECF sugieren una sensibilización periférica de los nociceptores, una hiperexcitabilidad de las neuronas centrales y una activación de los mecanismos de señalización, así como alteraciones de la función y la actividad cerebral que sugieren una sensibilización central. Se especula que la sensibilización central puede contribuir a la variabilidad en la intensidad del dolor y a que sea médicamente refractario a los tratamientos clásicos para el episodio agudo. La posible implicación terapéutica de estas observaciones es que los estados de dolor mediados centralmente responden mejor a los inhibidores de la recaptación de serotonina-norepinefrina y a los moduladores de los mecanismos centrales, mientras que los estados de dolor periféricos y nociceptivos pueden responder mejor a los opioides y a los analgésicos no esteroideos. Seguramente esta diferente respuesta esté relacionada con la activación de las células de la glía en el proceso de cronificación (38).
TRANSICIÓN DEL DOLOR AGUDO AL DOLOR CRÓNICO
La etiología de los episodios de dolor agudo en la ECF es compleja y se supone que se debe a múltiples factores específicos de la enfermedad, como el estrés oxidativo, la lesión por isquemia-reperfusión, la oclusión vascular y la neuroinflamación. Sin embargo, en la práctica clínica, los episodios de dolor agudo se etiquetan como “episodios de dolor agudo vasoclusivo”, sin tener en cuenta los estudios de diagnóstico para identificar la presencia de dolor neuropático y otros fenotipos de dolor. En consecuencia, se trata a los pacientes de manera no específica con paracetamol, antinflamatorios no esteroideos y opioides, que no necesariamente se dirigen a los mecanismos subyacentes que causan el dolor agudo. Este hecho justifica la realización de nuevos estudios para dilucidar la compleja biología del dolor agudo en la ECF, con el objetivo último de elaborar un “léxico del dolor” en la enfermedad de células falciformes que vincule eficazmente los subfenotipos de dolor y sus subyacentes patofisiología con intervenciones terapéuticas específicas. El inicio abrupto de los episodios de dolor agudo suele producirse en la espalda, las extremidades, el pecho y el abdomen. Entre los factores desencadenantes del dolor asociados temporalmente figuran, entre otros, las infecciones agudas, la deshidratación, el asma, las temperaturas frías y el inicio de la menstruación; sin embargo, a menudo no se identifica ningún factor desencadenante (39,40,41,42). Los episodios de dolor agudo pueden comenzar ya en los primeros meses de vida, aumentar su frecuencia con la edad y pueden contribuir al desarrollo de un síndrome de dolor crónico. Como se ha comentado anteriormente, el dolor agudo es causado por la vaso-oclusión recurrente de los eritrocitos falciformes con la consiguiente lesión de isquemia-reperfusión, mientras que el dolor crónico probablemente sea impulsado entre otros motivos, como la sensibilización del sistema nervioso central y la hipertrofia de las células de la glía (43).
El diagnóstico de un síndrome de dolor crónico en la ECM es difícil e incluye muchos factores de riesgo biológicos, psicológicos y sociológicos. Tradicionalmente, el dolor crónico se define como el dolor que persiste por lo menos de 3 a 6 meses después del tiempo normal de curación de un tejido. Sin embargo, se han establecido criterios diagnósticos consensuados basados en la evidencia para el síndrome de dolor crónico en la ECF, ya que estos pacientes sufren episodios de dolor recurrentes a lo largo de su vida desde la infancia, por ello se ha consensuado la siguiente definición: “episodios de dolor continuo en la mayoría de los días de los últimos 6 meses, ya sea en un solo lugar o en múltiples lugares del cuerpo”. Los mecanismos biopsicosociales y las afecciones de dolor crónico en la enfermedad de células falciformes se describen en un informe exhaustivo reciente del grupo de trabajo de colaboración que representa a varias organizaciones relacionadas con el dolor y la adicción, la Administración de Alimentos y Medicamentos de los Estados Unidos y la Sociedad Americana del Dolor para desarrollar la Taxonomía de la Sociedad Americana del Dolor AAPT (16). La propuesta de clasificación es para una sola condición de dolor, que etiquetamos como dolor crónico de ECF, con 3 subtipos: 1) dolor crónico de la enfermedad sin complicaciones; 2) dolor crónico de la enfermedad con complicaciones; y 3) dolor crónico de la enfermedad con presentación mixta (Tabla 1).

Por lo tanto, la evaluación del dolor de la ECF debe determinar si el dolor es agudo, crónico, no relacionado con la ECF o los tres. Se requiere una historia clínica detallada con el individuo afectado para distinguir entre los posibles tipos de dolor. El dolor asociado con el “síndrome de movimiento excesivo”, que se define como el dolor causado por movimientos repetitivos en las actividades cotidianas, puede ser mal entendido y tratado como un dolor agudo de la enfermedad, un síndrome de dolor crónico o un episodio de dolor agudo prolongado. La asociación temporal de la nueva aparición del dolor, junto con la ubicación y el tipo de dolor, puede ayudar al individuo afectado y al facultativo a distinguir la etiología del dolor. Los datos muestran que los individuos con ECF utilizan descripciones que sugieren tanto los orígenes del dolor nociceptivo (aplastamiento, perforación, desgarramiento) como neuropático (frío, zona caliente, punzante, calambres). Es obvio, por lo tanto, que la obtención de las características del dolor puede mejorar el tratamiento del mismo de la ECF (44).
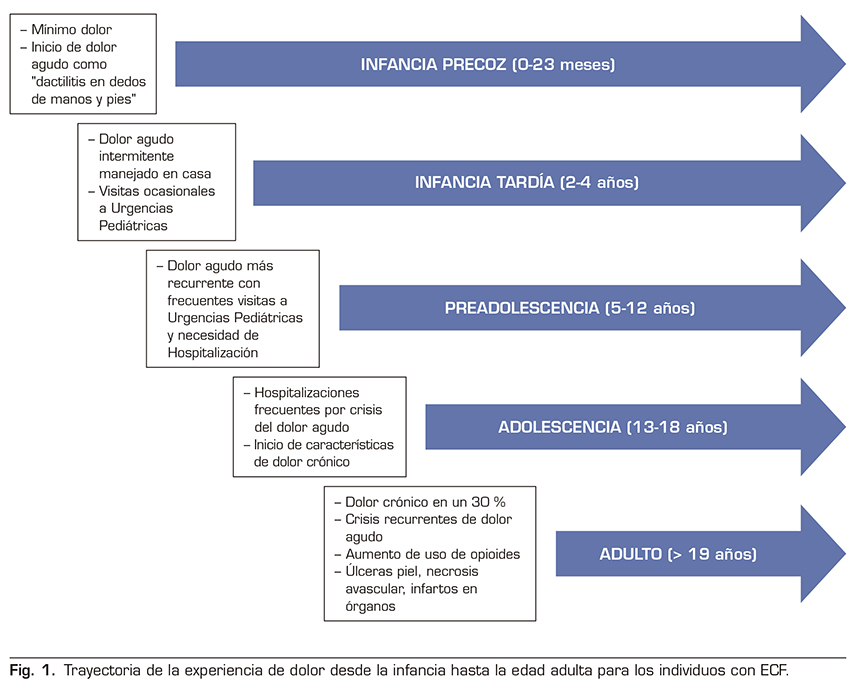
El dolor crónico se produce en una proporción significativa de pacientes con ECF, alrededor de un 30 %, y aumenta con la edad. Se ha observado como el dolor aparece desde edades tempranas (0-24 meses) en forma de crisis aisladas y fenómenos de dactilitis en manos y pies. Entre los 2-4 años, la mayoría de los episodios agudos se tratan en el hogar con consultas intermitentes al servicio de urgencias que van aumentando entre los 5-12 años, necesitando muchas veces hospitalización. En la adolescencia (13-18 años) el cuadro de crisis agudas se hace florido y aumentan los ingresos hospitalarios, aparecen cuadros de ansiedad, depresión y trastornos del sueño y un porcentaje de pacientes cumple ya criterios de dolor crónico definidos con anterioridad. En la edad adulta (> 19 años) estos pacientes presentan episodios de dolor agudo sobre un contexto de dolor crónico muchas veces con base de lesiones crónicas como úlceras cutáneas, necrosis avascular o infartos en diversos órganos y aumenta el consumo de analgésicos opioides (Figura 1) (45). El Estudio de Epidemiología del Dolor en la Drepanocitosis (PiSCES) mostró que el dolor crónico se producía en el 55 % de los adultos en el hogar en más de la mitad de los días y en el 29 % de los adultos en el 95 % de los días. La etiología del dolor crónico en la ECF no está clara. Sin embargo, entre las causas subyacentes del dolor crónico figuran la hiperalgesia prolongada después de un COV, el dolor específico de un órgano como la necrosis avascular y la hiperalgesia inducida por opioides (46).
Uso de opioides en la ECF
El proyecto PiSCES demostró que los opioides se utilizaban durante la mayoría de los días de dolor (78 %), y que los opioides de acción prolongada y liberación inmediata eran utilizados por el 38,8 % y el 47 % de los pacientes, respectivamente (46). Sobre el uso de opioides, un exhaustivo estudio retrospectivo (47) analizó un total de 3882 pacientes con una edad media de 17 años (rango intercuartil [IQR]: 9-36 años). El 45 % de los pacientes eran varones. Los medicamentos opioides fueron utilizados por el 39,9 % de los pacientes, el 31,8 % tomando solo fármacos de liberación inmediata, el 0,4 % tomando solo presentaciones de liberación prolongada, y el 7,8 % usando tanto formulaciones de liberación inmediata como prolongada. La prevalencia del consumo de opioides fue del 8,5 % en el grupo de 0 a 9 años de edad, aumentó significativamente al 46,3 % en el grupo de 10 a 19 años de edad (p < 0,0001), y alcanzó un máximo del 58,3 % en el grupo de 20 a 29 años de edad. Las dosis de medicamentos opioides fueron convertidas en equivalentes de morfina oral (EMO). La dosis diaria mediana entre los usuarios fue de 1,85 mg de EMO (IQR 0,62-10,68 mg). La dosis de opioides fue de 0,54 mg de EMO por día en los grupos de edad de 0 a 9 años, y significativamente más alta 1,07 mg (p = 0,0002) en los de 10 a 19 años. El grupo de edad de más de 50 años tenía la dosis más alta de opioides (6,03 mg EMO por día). En los pacientes no-adultos (0-17 años) que tomaban medicamentos opioides, la gran mayoría (87 %) usaba 0-5 mg de OME por día, y solo el 3 % usaba más de 30 mg de EMO por día. En cambio, el 55 % de los pacientes adultos (mayores de 18 años) usaron 0-5 mg de EMO por día, y el 23 % tomó más de 30 mg de OME diariamente. La dosis diaria de 30 mg de EMO al día se usó como el límite superior en este caso, ya que era una forma de dosificación comúnmente usada para la morfina. Los medicamentos que contienen hidrocodona y oxicodona se encontraban entre los opioides más comúnmente utilizados, tanto en pacientes pediátricos como adultos, cada uno de ellos representaba aproximadamente el 30 % del número total de recetas de opioides. Los medicamentos que contienen codeína se utilizaron con mayor frecuencia en la población pediátrica (27 %) en comparación con la población adulta (4 %). El uso de medicamentos opioides más fuertes como la morfina, la hidromorfona, la metadona y el fentanilo fue mayor en los pacientes adultos (27 %) en comparación con los pacientes pediátricos (16 %), teniendo en cuenta la adaptación en función del peso corporal.
La edad avanzada, el uso de hidroxiurea y el uso de los AINE fueron más comunes entre los usuarios de opioides en dosis altas. Las hospitalizaciones y las visitas al servicio de urgencias también fueron más comunes entre los consumidores de opioides en altas dosis. Estos pacientes experimentaron una mayor incidencia de crisis vaso-oclusivas (CVO) (p < 0,0001), síndrome torácico agudo (STA) (p = 0,0211), necrosis avascular (NVA) (p < 0,0001), e insuficiencia cardiaca crónica (ICC) (p = 0,0027). En los modelos de regresión logística multivariable, los pacientes de mayor edad que utilizaban hidroxiurea (OR 3,9, IC del 95 %: 2,8-5,5), y utilizaban AINE (OR 2,0, IC del 95 %: 1,4-2,7) tenían probabilidades significativamente mayores de utilizar altas dosis de opioides. La mayor frecuencia de hospitalizaciones (más de dos ingresos anuales) se asoció significativamente con el uso de altas dosis (OR 4,7; IC del 95 %: 3,2 a 6,9) de opioides. No fue habitual el uso de fármacos bloqueantes del receptor NMDA para evitar el efecto de tolerancia opioide a largo plazo. Las recomendaciones actuales sobre el uso de opioides en estos pacientes se basan en ajustar las expectativas del paciente junto a su familia y las metas a conseguir tanto en los episodios de dolor agudo como en el contexto de dolor crónico y entender la evolución de enfermedad (48), y están resumidas en la Tabla 2.

Depresión en la ECF
Un examen sistemático mostró una prevalencia estimada del 26 % de depresión en personas con ECF y también una mayor prevalencia en comparación con la población afroamericana en general. Las personas con ECF y depresión experimentaron más episodios de dolor. A su vez, el aumento de los episodios de dolor se asoció con más porcentaje de depresión. Los adultos con depresión presentaron un riesgo relativo 2,8 veces mayor de aumentar la utilización de la atención de salud mental que las personas sin depresión (49). El estudio epidemiológico del dolor en la ECF (PiSCES) examinó a 232 personas en busca de depresión y ansiedad (50). Las personas con depresión informaron de dolor en el 71 % de los días, en comparación con el 49 % de las personas sin depresión, y las personas con depresión informaron de una mayor intensidad del dolor y una mayor interferencia del mismo en sus actividades diarias. La ansiedad también se asoció con un mayor grado de dolor. Los niños con ECF y un trastorno de ansiedad tuvieron tasas de admisión hospitalaria más altas por el dolor y una mayor duración de la estancia en el hospital. Los adultos del estudio PiSCES con ansiedad informaron de una mayor intensidad media del dolor, mayor malestar relacionado con el dolor y un mayor uso de opioides. Estos datos subrayan la relación recíproca entre las condiciones de salud mental y el dolor crónico de la ECF. Los efectos a largo plazo del tratamiento de la depresión y la ansiedad sobre el dolor determinarán aún más esta relación en el futuro.
Dolor neuropático en la ECF
El diagnóstico y tratamiento del dolor neuropático en individuos con ECF es llamativamente subestimado. En los cuestionarios transversales de detección de dolor neuropático comunicados por los pacientes se ha estimado que el dolor neuropático se produce en un 25-40 % de los individuos con ECF. A pesar de los datos que respaldan la existencia de dolor neuropático, las estrategias sistemáticas para el tratamiento y la prevención del dolor en estos individuos brillan por su ausencia. El tratamiento del dolor neuropático puede ser difícil debido a la dificultad del diagnóstico, pero puede contribuir a mejorar la sensibilización central de estos pacientes, ya que muchos fármacos mejoran las vías descendentes del dolor. Entre los medicamentos considerados comúnmente como de primera línea para los tratamientos del dolor neuropático se encuentran los gabapentinoides (gabapentina y pregabalina), los inhibidores de la recaptación de la serotonina y noradrenalina y los antidepresivos tricíclicos (51). Los limitados datos epidemiológicos indican que los medicamentos para el dolor neuropático se utilizan con poca frecuencia en las personas con ECF. Se desconoce si ello se debe a la falta de datos de eficacia o a un diagnóstico insuficiente del dolor neuropático en esta población. En dos estudios que revelaron un fenotipo de dolor neuropático en personas con ECF utilizando instrumentos de selección comunicados por los pacientes, se encontró un uso poco frecuente de medicamentos para el dolor neuropático. Utilizando la herramienta PAINReportIt® (una versión computarizada del Cuestionario de Dolor McGill de Melzack [ © 1970 ]), los autores encontraron que el 90 % de los individuos describían su dolor utilizando palabras clásicamente asociadas con el dolor neuropático, sin embargo, solo el 5 % tomaba un medicamento específico para el dolor (51). Además, otros autores encontraron que el 37 % de los individuos tenían evidencia de dolor neuropático usando el questionario de exploración neuropática pain DETECT® y solo el 5 % estaba tomando un fármaco para el dolor neuropático (44). Un estudio investigó el uso de fármacos para el dolor neuropático en el entorno del mundo real en niños y adolescentes con ECF. Se analizaron datos del Sistema de Información de Salud de 53.557 visitas de pacientes hospitalizados para determinar la prevalencia y la demografía asociada de los medicamentos prescritos para el dolor neuropático (gabapentinoides, inhibidores selectivos de la recaptación de serotonina, antidepresivos tricíclicos). Los datos mostraron que solo el 2,9 % de los individuos recibieron un medicamento para el dolor neuropático. Las probabilidades de recibir un medicamento específico aumentaron significativamente con los mayores de edad y sexo femenino (52).
A diferencia de otras afecciones de dolor neuropático, no se han realizado revisiones sistemáticas de estos fármacos en personas con ECF debido al escaso número de ensayos clínicos controlados. Por lo tanto, los datos sobre el uso de medicamentos para el dolor neuropático en personas con ECF son limitados. En resumen, se muestran los datos de solo tres ensayos clínicos controlados que investigan los tratamientos centrados en el dolor neuropático en individuos con ECF; un estudio abierto de fase I con un fármaco neuroléptico (trifluoperazina) (53), un ensayo piloto controlado y aleatorizado de seguridad y viabilidad sobre pregabalina sobre 22 pacientes (54) y un estudio de un único brazo de fase II sobre lidocaína transdérmica de 3 días de duración (55). La ketamina (antagonista NMDA), un fármaco que ha demostrado ser eficaz para tratar algunas afecciones de dolor neuropático y cuadros de hiperalgesia, se está perfilando como un posible tratamiento para el dolor de la enfermedad. Los datos limitados sobre el uso de la ketamina para el tratamiento del dolor agudo (CVO) de la ECF sugieren que este fármaco puede ser eficaz (56,57), pero se necesitan estudios adicionales.
CONCLUSIONES
El dolor es la complicación más frecuente de la anemia drepanocítica o enfermedad de células falciformes (ECF) y la principal causa de hospitalización de las personas afectadas. Los episodios de dolor agudo son también un predictor independiente de la mortalidad y existe una clara transición desde los episodios agudos en la edad temprana a un cuadro de dolor crónico en, al menos, un 30 % de los pacientes en edad adulta. La fisiopatología del dolor es compleja y se ha atribuido a varios factores biológicos, entre ellos el estrés oxidativo, la vasoclusión, la lesión por isquemia de reperfusión, la inflamación local y finalmente un proceso de neuro-inflamación y sensibilización central que conduce a un síndrome de dolor crónico. A pesar de esta compleja biología, los eventos dolorosos que requieren hospitalización se denominan de manera simplista “episodios de dolor vaso-oclusivo agudo” por la comunidad de facultativos, y no debemos caer en la tentación de quedarnos en esta visión superficial, ya que en el fondo subyace un complejo cortejo de signos y síntomas clínicos que conducen a una afectación física y psíquica severa en estos pacientes que requiere un abordaje multidisciplinar biosicosocial (Figura 2).
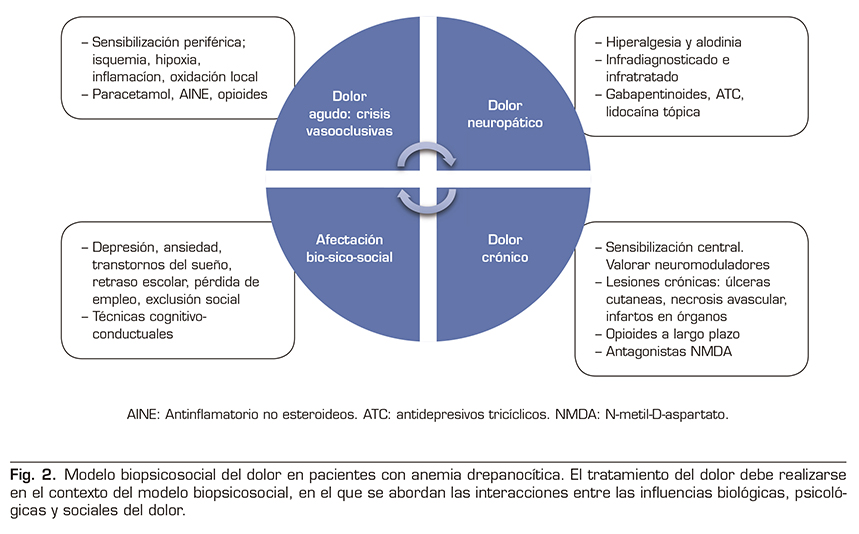
El dolor neuropático es un fenotipo emergente dentro del espectro doloroso de la ECF. Es causado por una lesión o enfermedad del sistema nervioso somatosensorial y se ha estimado que ocurre en aproximadamente el 25-40 % de los adolescentes y adultos con ECF. Las modalidades de diagnóstico para dolor neuropático, incluidos cuestionarios validados que incorporan descriptores del dolor, pruebas sensoriales cuantitativas y la neuroimagen funcional, se han evaluado en estudios transversales de tamaño pequeño en adolescentes y adultos con ECF. Sin embargo, estas pruebas diagnósticas no se utilizan actualmente en la atención de rutina de los pacientes. Se ha informado que la edad, el sexo femenino y el uso de hidroxiurea están positivamente asociados con dolor neuropático en la ECF, aunque los factores de riesgo definitivos para la prevención del dolor en esta población no han sido identificados. Unos pocos estudios de fase temprana han comenzado a investigar tanto el dolor neuropático como la sensibilización central con fármacos del grupo de los neuromoduladores (ketamina, pregabalina, lidocaína) en individuos con ECF. Sin embargo, las estrategias basadas en la evidencia para tratar el dolor en la enfermedad de células falciformes son escasas y la literatura existente sugiere que los tratamientos específicos para el dolor neuropático están muy poco utilizados y los antinflamatorios y los opioides siguen siendo los fármacos de primera línea, y por lo tanto sobreutilizados.
CONFLICTO DE INTERESES
Ninguno de los autores tiene conflicto de intereses.
BIBLIOGRAFÍA