DOI: 10.20986/resed.2019.3737/2019
ARTÍCULO ESPECIAL
Factores clave que afectan a la biodisponibilidad de los opioides sobre la médula espinal en el manejo del dolor agudo
Key factors governing spinal cord opioid bioavailability in the management of acute pain
B. Mugabure Bujedo
Departamento de Anestesiología, Cuidados Críticos y Medicina del Dolor. Unidad del dolor, Manejo del dolor agudo y crónico. Hospital Universitario de Donostia, San Sebastián, España
Recibido: 8-04-2019
Aceptado: 31-05-2019
Correspondencia: Borja Mugabure Bujedo
mugabure@yahoo.es
ABSTRACT
Although there is no either ideal analgesic or route of neuraxial administration, clinicians alike continue to search for compounds with qualities which may approach this idea. However, it´s a demonstrated fact that spinal administration of an opioid drug does not always guarantee segmental and selective analgesia into the spinal cord. This point is valid due to partial reuptake of the drug to systemic blood circulation reaching specific brain opioid receptors, rather than the differences are explained by variations in the clearance rate from the cerebrospinal fluid. Published evidence from either human or animal experimental studies indicates that bioavailability in the spinal cord biophase is negatively correlated with liposolubility. Therefore, opioid spinal cord bioavailability is higher for hydrophilic opioids like morphine, than for lipophilic ones such as fentanyl, sufentanil or alfentanil.
Keywords: analgesics, opioids, biological availability, opioid receptors, acute pain, spinal cord.
RESUMEN
Aunque no existe un analgésico ni una vía de administración neuroaxial ideal, los clínicos continúan buscando compuestos con cualidades que puedan acercarse a esta idea. Sin embargo, se ha demostrado que la administración espinal de un medicamento opioide no siempre garantiza una analgesia segmentaria y selectiva en la médula espinal. Este punto es cierto debido a la recaptación parcial del fármaco a la circulación sistémica sanguínea que alcanza receptores opioides cerebrales específicos, además de las diferencias que se explican por las variaciones en la tasa de eliminación del líquido cefalorraquídeo. La evidencia publicada de estudios experimentales en humanos o animales indica que la biodisponibilidad en la biofase medular está correlacionada negativamente con la liposolubilidad. Por lo tanto, la analgesia espinal es mayor para los opioides hidrófilos como la morfina, que para los lipófilos como el fentanilo, el sufentanilo o el alfentanilo.
Palabras clave: analgésicos, opioides, biodisponibilidad medular, receptores opioides, dolor agudo, médula espinal.
INTRODUCCIÓN
Los fármacos opioides se han utilizado para conseguir analgesia espinal durante más de un siglo y actualmente las inyecciones epidurales o intratecales tienen un papel clave en el control del dolor postoperatorio. Desde el descubrimiento del sistema opioide endógeno hace tres décadas, su uso se ha vuelto generalizado para la analgesia en obstetricia y para el tratamiento del dolor postoperatorio, además del dolor oncológico crónico (1). Es de suponer que la presencia de cualquier opioide en el cuerpo humano producirá cierto nivel de analgesia, pero no es necesariamente cierto que la administración neuroaxial garantice su acción a nivel de la médula espinal e, incluso si así fuera, que el efecto sea mejor que la analgesia lograda por otras vías de administración sistémicas como la intravenosa o la subcutánea. De hecho, no todos los opioides administrados vía neuroaxial producen analgesia espinal. Por ello, para usar los opioides de manera efectiva para este tipo de analgesia, es importante comprender la fisiología y la farmacología clínica de estos principios activos, centrándose en los que producen analgesia por un mecanismo espinal intrínseco. En resumen, podríamos decir que las pruebas de ensayos en animales y humanos indican que los opioides hidrofílicos, como la hidromorfona, la diamorfina y la morfina, se unen más fuertemente a receptores específicos dentro del asta dorsal de la médula espinal, lo que se entiende como selectividad y biodisponibilidad de la médula espinal, que los opioides lipofílicos, como alfentanilo, fentanilo y sufentanilo. Esto es atribuible a las diferencias en las propiedades farmacocinéticas y farmacodinámicas de los dos grupos. Es más difícil para los opioides lipófilos alcanzar y permanecer en concentraciones suficientemente altas en el lugar de acción o biofase medular en la lámina II de Rexed, debido a su secuestro en la grasa epidural y al rápido aclaramiento plasmático de los espacios epidural e intratecal, lo que da como resultado una analgesia con una extensión y duración limitadas, así como la aparición de efectos secundarios supraespinales tempranos. En contraste, la morfina y demás opioides hidrofílicos tienen propiedades muy diferentes, que incluyen una mayor biodisponibilidad y esto significa que, administrada vía neuroaxial, su tiempo de residencia en su compartimento efecto es mayor y, por lo tanto, es una opción adecuada para el tratamiento del dolor agudo (2).
El propósito de esta revisión narrativa fue determinar los factores clave para explicar qué opioides alcanzan concentraciones suficientemente altas para producir analgesia selectiva cuando se administra por vía epidural o intratecal y hacer algunas recomendaciones sobre su uso racional para el tratamiento del dolor postoperatorio. Con este fin, se realizó una búsqueda en Ovid / Medline / Embase / Cochrane Database para identificar todos los artículos publicados hasta diciembre de 2018 utilizando las palabras clave: analgésicos, opioides; disponibilidad biológica; receptores opioides; dolor agudo; médula espinal.
Los términos de búsqueda incluyeron lo siguiente:
Dolor agudo posoperatorio ± morfina, fentanilo, alfentanilo, sufentanilo.
Bloqueo neuraxial ± receptores opioides. Para los opioides se han recopilado revisiones sistemáticas, metanálisis o revisiones Cochrane. Para los agentes que no se han sometido a una combinación de datos tan sistemática se valoraron individualmente para realizar una revisión narrativa.
Para biodisponibilidad medular se obtuvieron los estudios pertinentes a través de una búsqueda en Medline y se revisaron individualmente para identificar cualquier estudio que pudiera haberse perdido en la búsqueda principal. Se recuperó material adicional mediante la revisión manual de referencias de artículos relevantes identificados con mayor nivel de impacto y citas previas.
Todas las citas bibliográficas finalmente incluidas se eligieron por el autor con el fin de conseguir enfocar la revisión en los términos previstos.
MECANISMOS QUE RIGEN LA DISTRIBUCIÓN ESPINAL DE LOS OPIOIDES
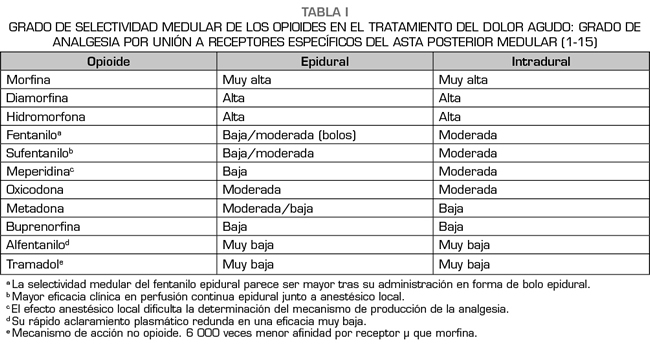
Todos los fármacos opioides producen analgesia por el mismo mecanismo molecular, es decir, a través de una disminución en la excitabilidad de las células nerviosas. Para lograr esto, necesitan unirse a la proteína G, inhibir la enzima adenilato-ciclasa y estimular la activación de los canales de potasio, así como conseguir la inhibición de los canales de calcio dependientes del voltaje. Dado este mecanismo común, es lógico preguntarnos por qué existen tantas diferencias clínicas entre los opioides. La explicación reside en sus características farmacocinéticas y farmacodinámicas y qué implican estas para la selección del régimen farmacológico postoperatorio óptimo (3). En consecuencia, durante las últimas tres décadas, el esfuerzo científico en este campo se ha centrado en la realización de ensayos clínicos controlados para determinar cuál de los opioides disponibles es el más adecuado para el uso vía espinal. Se suele suponer que, al menos en algunos aspectos, la administración neuroaxial de opioides produciría una mejor analgesia con relación al uso de otras vías parenterales y también menos efectos adversos, incluida la depresión respiratoria. Desafortunadamente, esto no siempre es cierto, ya que muchos opioides pueden alcanzar los centros cerebrales superiores a través del líquido cefalorraquídeo (LCR) o por su reabsorción al torrente sanguíneo, lo que redunda en una biodisponibilidad espinal muy baja (4) (Tabla I).

Estudios experimentales en animales
Difusión epidural
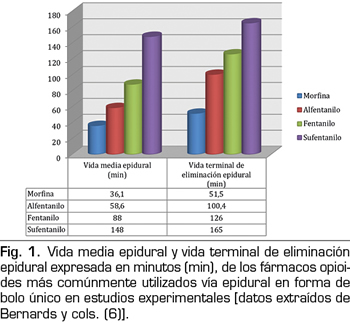
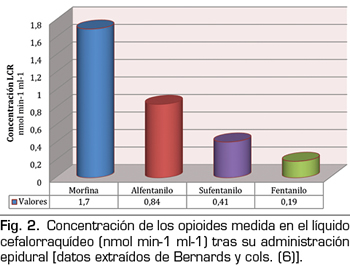
Para que los fármacos opioides surtan efecto analgésico medular deben moverse desde el espacio epidural al lugar específico de acción en la materia gris del asta posterior medular. Por lo tanto, uno de los factores más importantes a considerar es la capacidad de los fármacos para redistribuir a los tejidos vecinos, difundiéndose lejos del espacio epidural y específicamente cruzando una gama de barreras como las meninges, el LCR y la sustancia blanca espinal. En general, todas las sustancias difunden siguiendo un gradiente de concentración; por lo tanto, cualquier opioide colocado en el espacio epidural tenderá a propagarse a los tejidos circundantes. Sin embargo, la velocidad y la distancia a la que un fármaco se mueve en un tejido específico depende del volumen de ese tejido y de sus propiedades físicas y químicas en relación con las de dicho fármaco. En particular, las leyes de la termodinámica favorecen la acumulación de fármacos hidrófobos en tejidos con propiedades similares. Dado esto, se puede esperar que el fentanilo y el sufentanilo difundan preferentemente en la grasa epidural en lugar del LCR, por lo que ya no estarán disponibles para los receptores opioides de la columna vertebral. La grasa epidural, localizada principalmente en las partes laterales y posteriores del espacio epidural, amortigua la pulsación del saco dural y facilita el movimiento del periostio del canal espinal, durante la flexión y extensión de la columna vertebral. Dada su naturaleza lipófila, se comporta como un reservorio de fármacos solubles en lípidos, lo que puede producir una liberación sostenida del fármaco y una analgesia prolongada (5). En un modelo animal (cerdos), Bernards y cols. (6) exploraron la administración de diferentes opioides epidurales mediante bolos (morfina, fentanilo, alfentanilo y sufentanilo) y midieron su concentración a lo largo del tiempo en el espacio y la grasa epidural, el espacio intradural, el plasma venoso central y el plexo venoso epidural. Demostraron que el tiempo de residencia en el espacio epidural y la concentración en la grasa epidural se correlacionaron directamente con la liposolubilidad del fármaco, siendo ambos más altos para sufentanilo y fentanilo y más bajos para morfina (Figura 1). Específicamente, se encontró que la concentración acumulada en la grasa epidural era 32 y 20 veces más alta para el fentanilo y el alfentanilo respectivamente que para la morfina y, en consecuencia, cantidades menores de los opioides anteriores alcanzan la biofase espinal. Además, como podría esperarse, la proporción de fármaco que alcanzó el LCR fue mayor para la morfina que para los opioides lipófilos, que fueron secuestrados en la grasa (Figura 2). Finalmente, encontraron que el alfentanilo tenía la concentración plasmática más alta del grupo de opioides debido a su rápida eliminación hacia el compartimento central vascular.
Difusión meníngea
Los estudios experimentales sugieren que el mecanismo primario por el cual los opioides alcanzan el LCR es difusión simple a través de las meninges, ayudado por la energía cinética del flujo pulsátil del LCR asociado al movimiento secundario de la médula espinal. Concretamente, se ha observado que la difusión a través de las vellosidades aracnoides en las raíces de la médula espinal (7) y las arterias radiculares implicadas en su vascularización (8) no participan en este proceso. Aunque hay diferencias entre los fármacos opioides, estas no parecen ser importantes en la redistribución desde epidural a los espacios más profundos subaracnoideos.
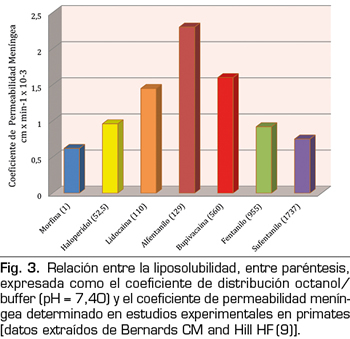
Hay una relación bifásica entre la solubilidad del fármaco y la permeabilidad de la aracnoides (9). Al principio, la permeabilidad aumenta con el aumento de la solubilidad a lípidos, pero solo hasta los valores moderados (alrededor de 125) del coeficiente de distribución octanol/buffer. En valores más altos, la permeabilidad disminuye significativamente con la solubilidad. En consonancia con esto, los coeficientes de la permeabilidad meníngea de la morfina (M) y del sufentanilo (S) son similares, 0,6 y 0,75 respectivamente, pero sus coeficientes de distribución del octanol/buffer son muy diferentes, 1 (M) y 1787 (S) (Figura 3). La explicación de esta relación bifásica radica en el hecho de que los fármacos tienen primero que cruzar las bicapas lipídicas de las células de la aracnoides y luego progresar a través de los fluidos de los espacios extra e intracelulares. Los fármacos altamente lipofílicos completan el primer paso fácilmente pero el segundo con dificultad, mientras que para los fármacos hidrófilos el mecanismo opuesto es más correcto. Esto, junto con el hecho de que la aracnoides es la principal barrera para la permeabilidad meníngea (90 %), explica por qué los fármacos con valores intermedios de solubilidad lipídica (lidocaína o alfentanilo) logran mejores tasas de transferencia de manera global en este tipo de tejidos.
Por ello, y aunque las meninges no desempeñan un papel esencial como barrera física selectiva para la difusión espinal de opioides, es, sin embargo, digno de resaltar su función esencial como lugar para la regulación de la absorción intratecal de fármacos, dada la red densa de capilares en la superficie interna de la duramadre. Esta conclusión se basa en los resultados de dos estudios experimentales en animales: Kozody y cols. (10) demostraron que la administración espinal de adrenalina y fenilefrina redujo significativamente el flujo sanguíneo a la duramadre sin afectar a la de la médula espinal y Bernards y cols. (11) encontraron que la administración de adrenalina junto con un opioide epidural hidrofílico como morfina redujo su aclaramiento plasmático y concluyeron que fue probablemente debido a la constricción del flujo sanguíneo a la duramadre.
Transporte intratecal
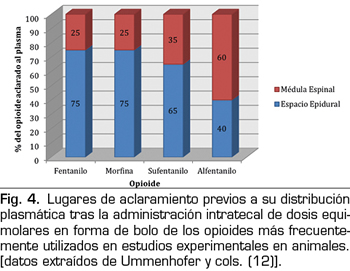
Sin diferencias entre la baricidad, el volumen de fármaco administrado, el lugar de inyección o la energía cinética proporcionada por la propia inyección, los opioides que alcanzan el LCR deberían comportarse de manera similar. Ummenhofer y cols. (12) encontraron que el volumen de distribución de los opioides inyectados vía intratecal estaba directamente relacionado con su solubilidad lipídica, siendo el volumen 40 veces mayor para el sufentanilo que para la morfina. Esto significa una redistribución rápida del compartimiento intratecal hacia ambientes más lipofílicos, y en ese estudio, la ruta más crucial del aclaramiento fue a través de las meninges hacia el espacio epidural, salvo para alfentanilo (Figura 4). La implicación con respecto a los opioides lipofílicos es que su propagación rostral a través del LCR es, por lo tanto, limitada y su biodisponibilidad espinal es relativamente débil.
El mecanismo primario para que los fármacos se propaguen a través del LCR es el movimiento del fluido en sí. La energía asociada proviene del flujo pulsátil en el sistema nervioso central. Este aumenta transitoriamente el volumen del cerebro y en menor medida el de la médula espinal, obligando al LCR en dirección caudal por la superficie dorsal y dirección craneal por la ventral. Este efecto es mayor en las zonas cercanas a las metámeras medulares cervicales C4-C5, y mínimo en la zona lumbar baja. A medida que el LCR se mueve, lleva consigo diluida cualquier molécula suspendida en él, y este mecanismo no induce ninguna diferencia entre los opioides, que también pueden propagarse por difusión. La velocidad de difusión simple de cualquier molécula en un fluido ideal es proporcional a la temperatura del líquido e inversamente proporcional a la raíz cuadrada de su peso molecular. Sin embargo, dado que la temperatura del LCR es constante y la raíz cuadrada del peso molecular de diferentes opioides es similar y oscila entre 17 y 20, las tasas teóricas de difusión son idénticas para todos los fármacos opioides y no pueden explicar las diferencias observadas en su propagación a través del LCR. En cambio, las diferencias sí se explican por las variaciones en la tasa de aclaramiento del LCR, dado que si un fármaco desaparece de este compartimento rápidamente, hay, por definición, poco resto para propagarse rostralmente y, a su vez, producir analgesia espinal. Por ejemplo, en los seres humanos, la tasa de aclaramiento de sufentanilo (27 μg/kg/min) es casi 10 veces más rápida que la de la morfina (2,8 μg/kg/min). Por esta razón, este último fármaco permanece en el LCR por más tiempo y tiene, por lo tanto, más probabilidades de extenderse hacia el cerebro y causar otros efectos supraespinales como la sedación y la depresión respiratoria (2-4).
En un fascinante estudio experimental en animales (cerdos) (13), se descubrió que después de la infusión continua intratecal de bupivacaína y baclofeno existía una redistribución interna muy pobre a través del LCR y las diferencias en las concentraciones de los fármacos eran muy importantes entre las superficies posteriores y anteriores de la médula espinal, existiendo un gradiente rostro-caudal. Este último gradiente, previamente observado para la albúmina y la glucosa, es atribuible a una pequeña transferencia de energía cinética de la fase de sístole del ciclo cardiaco y al alto grado de compartimentalización anatómica interna de este espacio intradural. Después de 8 horas de infusión, los fármacos se habían extendido no más de 7 cm del lugar de punción y se detectaron a esta distancia en concentraciones mucho más altas en la parte posterior que en la superficie anterior de la médula espinal. Por lo tanto, los factores que son clínicamente importantes para determinar la analgesia espinal son la tasa de aclaramiento de fármacos del LCR y la cantidad de fármaco disponible en la biofase espinal, así como la semivida de eliminación. La biodisponibilidad de los fármacos será mayor cuando se adhiera directamente al asta posterior de la médula espinal en lugar de distribuirse a través de la sangre o el espacio epidural. También debemos determinar qué fracción del efecto analgésico se puede atribuir a una acción espinal y qué a una acción supra espinal, así como si este último es necesario para el efecto analgésico final observado (2-6).
Acción analgésica medular
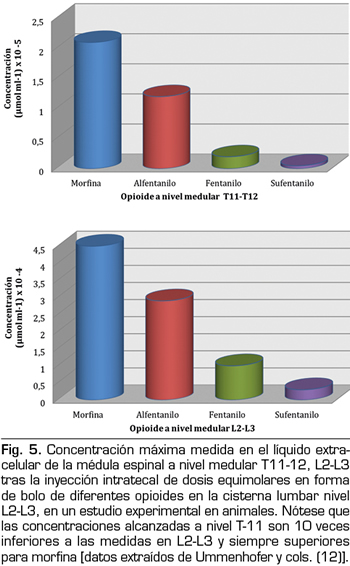
Finalmente, el último paso para los opioides ya presentes en la médula espinal es cruzar la materia blanca y unirse a los receptores específicos en la materia gris. En un estudio clásico en los años 70, von Cube y cols. (14) inyectaron morfina, hidromorfina y fentanilo marcados radioactivamente en el LCR de los ventrículos laterales de conejos y midieron la distancia alcanzada en los tejidos vecinos del sistema nervioso central a lo largo del tiempo. Encontraron que los tres fármacos penetraron 700 µm en los primeros 7 minutos, pero, a medida que pasaba el tiempo, el fentanilo no avanzó más y se eliminó del tejido cerebral en 120 minutos. En contraste, la distribución de morfina e hidromorfina continuó y al final del estudio, después de 5 horas, la morfina había alcanzado una profundidad de tejido de alrededor de 3000 µm. Una observación aún más sorprendente fue que el fentanilo tenía una mayor afinidad por la materia blanca, en comparación con los fármacos solubles en agua, que tenían más afinidad por la materia gris. Más recientemente, a finales de los años 90, este hecho se confirmó en un modelo experimental en cerdos (12), con administración intratecal de morfina, alfentanilo, sufentanilo y fentanilo, en dosis equimolares, y mediciones posteriores de las concentraciones de los fármacos en el espacio extracelular de la médula espinal. La exposición a la morfina fue mayor que la de todos los fármacos lipofílicos, ya que tenía una concentración 3 veces mayor, tanto en la columna lumbar al nivel de la inyección (L2-L3) como en la columna torácica (T11-T12) (Figura 5). La explicación de estas observaciones es que la materia blanca se compone principalmente de membranas de plasma axonal rodeadas por capas de células de Schwann y, en consecuencia, tiene un contenido de lípidos de alrededor del 80 % y, por lo tanto, una mayor afinidad por los opioides lipófilos. Como la materia gris no contiene mielina, es relativamente hidrófila y, por lo tanto, tiene una mayor afinidad por la morfina. Bernards CM (15) revisó en 2004 los estudios experimentales en animales que miden las concentraciones de opioides en los espacios epidural e intratecal, la médula espinal y los tejidos circundantes después de la administración epidural o intradural. Su trabajo concluyó que estos datos en animales nos ayudan a comprender los hallazgos de varios ensayos clínicos sobre el efecto analgésico de los opioides lipófilos, es decir, que el resultado se debe en parte, o incluso exclusivamente en algunos casos, a la captación por el plasma y la redistribución hacia receptores opioides centrales del cerebro y no a su acción selectiva medular.
Recientemente, se han estudiado la potencia y algunos efectos adversos de una serie de péptidos opioides de pequeño tamaño denominados péptidos DALDA (DMT-DALDA, dDALc, dDALcn, dDAL-TICP y dDAL-TIPP) después de la administración en forma de bolo intratecal en ratas. Se hizo especial hincapié en separar los efectos adversos de los efectos antinociceptivos reales. Estos péptidos son hidrófilos, como la morfina, lo que puede hacer posible que se puedan usar para producir un efecto de larga duración después de una dosis única en bolo intratecal. Debido a que la administración intratecal continua es algo problemática en la práctica clínica, especialmente después de los efectos adversos relacionados con el uso de catéteres espinales, una analgesia prolongada después de una dosis única sería una propiedad altamente deseable dentro de la analgesia espinal. Obviamente, antes de cualquier aplicación clínica, se necesita más investigación sobre su eficacia y su seguridad. En este estudio los animales de experimentación se trataron con morfina intratecal durante cinco días antes de la administración de DMT-DALDA, y se observó que el efecto analgésico no se redujo como ocurre con la morfina como resultado del desarrollo de la tolerancia. Esta tolerancia asimétrica es interesante, ya que podría indicar que el péptido tiene un mejor efecto intrínseco en comparación con la morfina y abre una línea prometedora de investigación (16).
Estudios sobre difusión espinal experimentales en humanos
Estudios experimentales clásicos
El opio es el látex seco obtenido del Papaver somniferum y el uso de la planta en sí tiene una larga historia en el desarrollo de la humanidad. El uso médico generalizado de opio no procesado fue una práctica común a lo largo de los siglos hasta que la morfina fue descubierta por primera vez en 1804 por un farmacéutico alemán, Friedrich Sertürner, quien distribuyó este medicamento por primera vez en 1817 (17). El cirujano rumano Racoviceanu-Pitesti informó sobre su experiencia utilizando una mezcla de cocaína y morfina en 1901, y realizó la primera publicación sobre el uso de opioides en anestesia espinal (18). Después del desarrollo de nuevos agonistas/antagonistas opioides en la década de 1940, los científicos empezaron a creer que debían existir otros lugares de unión naturales en el cerebro para estos fármacos similares a los opiáceos. Estos problemas se superaron en 1973 cuando Pert y Snyder caracterizaron aún más las propiedades de esta unión específica para los opioides en el tejido nervioso (19). Estos receptores no solo residían en el cerebro, sino también en la sustancia gelatinosa de la médula espinal. Más adelante, Fields y cols. encontraron que el tejido aferente primario de la raíz dorsal y el asta dorsal de la médula espinal contenían múltiples tipos de receptores opioides (20). El año 1975 fue crucial en relación con el descubrimiento de opioides endógenos (encefalinas) por Kosterlitz y cols. (21). Además, fue un hecho comprobado por Yaksh y cols. (22) que la aplicación directa de morfina en la columna vertebral de ratas mediante un catéter intratecal produjo analgesia, y esta práctica se convirtió en una realidad cuando Wang y cols. usaron con éxito la inyección intratecal en bolo de morfina en seres humanos (23). Asignaron al azar a ocho pacientes con dolor debido a cáncer genitourinario para recibir ya sea solución salina sola o junto con 0,5-1,0 mg de morfina. Seis de ellos informaron un alivio completo del dolor después de la inyección de morfina, que duró 12-24 horas. La publicación de Behar y cols. en The Lancet, en 1979, se constituyó en el primer artículo sobre el uso de morfina epidural en dosis de 2 mg tanto para el tratamiento del dolor agudo como crónico (24). Los autores informaron que lograron aliviar el dolor durante entre 6 y 24 horas en 10 pacientes y sugirieron que había un efecto espinal directo en los receptores específicos de la médula espinal. Por lo tanto, transcurrió más de un siglo hasta que el uso de opioides neuraxiales se convirtió en una rutina clínica para conseguir analgesia en pacientes agudos y crónicos.
Después de su administración en el interior del canal vertebral, los opioides se distribuyen de forma compleja, lo que puede describirse mediante un modelo multicompartimental. Un fármaco depositado directamente en, o que alcanza, el espacio intratecal sufre simultáneamente un movimiento en una dirección caudal en el lado dorsal de la médula espinal, y luego sube por el lado ventral hacia craneal. Posteriormente, en su difusión en la médula espinal, se une a receptores específicos en la materia gris y también a receptores no específicos en la materia blanca. También difunde en la dirección opuesta, hacia el espacio epidural, quedando secuestrada en la grasa epidural y, por último, la depuración hacia la sangre, de cada uno de estos compartimentos. El equilibrio entre todos estos procesos, descrito en relación con la biodisponibilidad espinal del fármaco, determina sus características clínicas y su eficacia analgésica general (25). Existe cierta evidencia de que la depresión respiratoria, la sedación y el prurito están asociados con el grado de migración rostral de los opioides en el LCR y el momento de aparición de estos efectos secundarios varía entre los opioides lipófilos e hidrófilos. Se ha estimado que la morfina administrada en la cisterna lumbar alcanza la cisterna magna en 1-2 horas y los ventrículos cuarto y lateral en 3-6 horas. Por otro lado, los opioides lipófilos también pueden tener un efecto central, ya que se distribuyen más rápidamente a través del torrente sanguíneo, alcanzando así el sistema nervioso central. Además, aunque en menor medida, la distribución también se produce a través del LCR, habiéndose encontrado trazas de opioides, incluso sufentanil en la cisterna magna solo 30 minutos después de la administración intratecal lumbar (26). Se ha encontrado que el fentanilo alcanza una concentración máxima de LCR cervical tan pronto como 10 minutos después de la administración epidural lumbar, en un promedio del 10 % de las concentraciones máximas de LCR lumbar, con una gran variabilidad individual (27). En este estudio, se encontró que el fentanilo penetraba muy poco en el LCR cervical y lumbar después de la administración intravenosa, y solo 4 de las 60 muestras de LCR estudiadas tenían concentraciones detectables de fentanilo. En contraste, después de la administración epidural lumbar, la penetración del fentanilo a través de la duramadre fue de mayor magnitud y rapidez. Para investigar la diseminación cefálica de opioides, a un grupo de voluntarios sanos se les administraron inyecciones intratecales de 50 μg de fentanilo (F) junto con la misma dosis de morfina (M), en el interespacio palpable más bajo (L5-S1), y se tomaron muestras de LCR en el nivel más alto posible en el espacio lumbar (L2-L3) que se analizaron hasta 120 minutos después de la inyección. Se encontró que ambos fármacos alcanzaron su concentración máxima en el punto más cefálico en tiempos similares (41 ± 13 min para F y 57 ± 12 min para M), mientras que la relación de concentración de M : F aumentó de 2 : 1 después de 36 minutos a 4 : 1 después de 103 minutos, y ninguna constante de velocidad se correlacionó con el peso, la altura o el volumen del LCR. Estos hallazgos se explicaron utilizando un modelo farmacocinético simple con una variabilidad individual relativamente alta. Los autores concluyeron que el fentanilo se elimina más rápidamente que la morfina del LCR por tener un aclaramiento mayor, aunque la distribución en la primera hora después de la administración es similar en los dos fármacos (28).
Si bien la administración de opioides espinales puede ser claramente una técnica analgésica efectiva, existe una idea errónea generalizada de que cualquier opioide administrado epidural o intratecalmente siempre producirá analgesia por un mecanismo espinal selectivo. Esto no es del todo cierto, ya que varios opioides que se administran comúnmente por vía espinal también pueden producir analgesia temprana por absorción en la circulación sistémica, con la redistribución posterior a los receptores opioides del tronco cerebral. Esto es más aplicable para los lipófilos porque su concentración analgésica mínima (CAEM) es demasiado baja y se puede alcanzar fácilmente en plasma después de la administración neuroaxial (0,03 μg/ml para sufentanilo y 0,63 μg/ml para fentanilo). Por lo tanto, en algunos casos, la analgesia producida podría no ser superior a la producida por la administración intravenosa (i.v.). Por otro lado, los opioides hidrofílicos, como la morfina (CAEM 9-30 μg/ml), permanecen durante un tiempo suficiente en el líquido cefalorraquídeo (LCR) para que la recirculación cefálica produzca un retraso en la analgesia o efectos adversos (2-6). Es por ello que existen aún controversias respecto a la acción selectiva medular de los opioides lipofílicos, como fentanilo, vía epidural. En un estudio experimental de dolor en voluntarios por Ginosar y cols. (29), el fentanilo epidural causó analgesia segmentaria cuando se administró como un bolo y no segmentaria o sistémica cuando se administró como una infusión continua. La respuesta al dolor máximo tolerable se evaluó sobre un periodo de 420 min con estímulos eléctricos y térmicos en dos regiones, en cabeza y pierna (supraespinal y espinal respectivamente). Las concentraciones plasmáticas de fentanilo se midieron y solo se encontraron poder alcanzar la CAEM después de una infusión continua en altas dosis. Los hallazgos estuvieron mayormente de acuerdo con los estudios anteriores revisados y fueron explicados por el nivel más alto de fentanilo que alcanzó la médula espinal o biofase en el grupo de bolo. Se ha sugerido que este efecto se debe al gradiente de concentración alcanzada entre la zona epidural y el espacio intratecal tras la administración en bolos y no en infusión continua. La dosis que el fentanilo necesitaría alcanzar para producir anestesia espinal se ha estimado en alrededor 10 μg/ml. En consecuencia, si en la práctica clínica postoperatoria de rutina combinaron este opioide con una infusión de AL a dosis de 2-5 μg/ml, lo que esperamos lograr sería una mejora de la analgesia al disminuir la dosis de AL, con un potencial efecto sistémico y, por tanto, un efecto aditivo en lugar de uno sinérgico espinal (30). Por lo tanto, estos hallazgos pueden ayudar a resolver la controversia que rodea el lugar de acción del fentanilo epidural según su modo de administración pero se necesitan ensayos en el futuro para evaluar esta afirmación.
En relación con este tema, Mather y Cousins ??(31) opinaron que es sensato no pensar en los mecanismos supraespinales y espinales en términos de una dicotomía. A pesar de los comentarios sobre fármacos lipofílicos como el fentanilo que se distribuye en la grasa epidural, innumerables estudios con opioides inyectados epiduralmente y AL (recuerde que el fentanilo y la bupivacaína tienen propiedades fisicoquímicas similares) han demostrado que la absorción sistémica tiene un perfil de concentración en la sangre similar al de la inyección intramuscular (i.m.). Los patrones de absorción bifásicos encontrados se pueden interpretar como una “porción” de la dosis que se absorbe de manera razonablemente rápida con una vida media de alrededor de 5 a 10 minutos, generando la concentración sanguínea arterial “máxima” en alrededor de 10 -20 minutos después de la inyección. La “porción” restante, presumiblemente que se distribuye en los tejidos grasos, se absorbe más lentamente con una vida media de varias horas, lo que mantiene las concentraciones de fármaco en la sangre en comparación con la administración de fármacos por vía intravenosa. Por lo tanto, el fármaco transmitido por la sangre se unirá tanto a los receptores supraespinales como a los de la columna vertebral en proporción a la distribución del gasto cardiaco, además del fármaco administrado por mecanismos locales de difusión. Aunque la cantidad de fármaco en plasma que se uniría a receptores opioides supraespinales puede ser pequeña después de la administración epidural en comparación con la inyección intravenosa, hay que recordar, como se señaló en la farmacología de los opioides espinales previa, que las acciones opioides duales espinales y supraespinales tienen una acción de refuerzo que es relevante tanto para el agonista como para el antagonismo clínico.
Estudios computacionales y en vitro
En estudios experimentales en seres humanos, se demostró que tanto la frecuencia cardiaca como el volumen de pulso en el LCR del paciente influyen determinantemente en la distribución del fármaco después de la administración intratecal. El efecto pulsátil sobre el LCR debido a la frecuencia y volumen sistólico cardiaco fue investigado para una inyección en forma de bolo de un fármaco modelo en el nivel vertebral L2. Los perfiles de distribución de fármaco a lo largo de toda la columna vertebral se calcularon para diferentes frecuencias cardiacas: 43, 60 y 120 (latidos por minuto) lpm, y diferentes volúmenes de inyección: 1, 2 y 3 ml. La duplicación de la frecuencia cardiaca, de 60 a 120 lpm, causó una disminución del 26,4 % en la concentración máxima en el LCR después de la inyección. Asimismo, el aumento del doble del volumen de inyección disminuyó el nivel máximo después de la inyección en un 38,1 %. Los cálculos muestran que los niveles potencialmente tóxicos de los fármacos debidos al modo de inyección se pueden evitar cambiando la velocidad de infusión. El uso de velocidades de infusión más lentas podría evitar altas concentraciones máximas en el LCR mientras se mantienen los niveles de fármaco por encima del umbral terapéutico (32). En otro estudio reciente, los autores adquirieron datos anatómicos de imágenes de resonancia magnética (RMN) y mediciones de velocidad en el líquido cefalorraquídeo con RMN CINÉTICA para dos sujetos voluntarios. Usando reconstrucciones a partir de datos de RMN, también introdujeron un modelo informático específico para el sujeto para predecir la propagación del fármaco. Los resultados encontrados fueron sorprendentes. Las mediciones de velocidad en tres regiones espinales de interés coincidían razonablemente con los campos de flujo simulados en la computadora específica del sujeto. La infusión de fármacos en forma de multibolos simulada localizaba teóricamente el fármaco en la región cervical y torácica alta. Por otro lado, la inyección en forma de infusión continua y la inyección de un solo bolo fueron ventajosas para concentrar el fármaco en el punto determinado de inyección en la columna lumbar. Los autores presentaron unas pautas potenciales que tienen en cuenta la cinética específica del fármaco para la captación final en un punto de tejido, que influye en la velocidad de dispersión del fármaco en el modelo (33). Este estudio también cuantifica cómo la cinética de inyección cambia radicalmente la ubicación específica de la acción final del fármaco. Debido a las diferentes captaciones tisulares de 3 agentes de uso habitual (morfina, sufentanilo, alfentanilo), una fracción más alta de sufentanilo y morfina permaneció en el LCR, a lo largo del neuroaxis, lo que indujo una acción más fuerte en la región cervical superior. En el tratamiento clínico crónico del dolor cervical, estos agentes podrían utilizarse con más potencia, mientras que la simulación preliminar demuestra que el alfentanilo podría ser más adecuado para el dolor lumbar, según nuestra alta tasa de captación por los tejidos circundantes al punto de inyección. Sin embargo, para un dolor asociado con el cáncer, la morfina se distribuiría más fácilmente a lo largo de todo el eje espinal.
CONCLUSIONES
Como el profesor Bernards, solía decir: “Cada opioide inyectado en el cuerpo humano, desde la oreja derecha hasta el pie izquierdo, inducirá un efecto analgésico debido a la distribución sistémica a los receptores cerebrales. Por lo tanto, la administración espinal de un opioide no siempre garantiza un efecto medular selectivo”. Existe un consenso en la comunidad científica de que los opioides son los fármacos de acción central más potentes disponibles en el arsenal para tratar tanto el dolor postoperatorio como el crónico. Sin embargo, el debate continúa sobre si la vía neuroaxial mantiene un perfil de eficacia/seguridad para obtener analgesia espinal selectiva (1-6). Los experimentos en animales o humanos apoyan la teoría de que la biodisponibilidad en la biofase espinal es inversamente proporcional a la solubilidad del fármaco, que es más alta en opioides hidrofílicos que en lipofílicos (7-15). Por lo tanto, la morfina epidural se considera muy útil en pacientes con dolor agudo y postoperatorio pero su corta duración de acción por menos de 24 horas limita la utilidad de las inyecciones en bolo, y los efectos adversos se asocian con el aumento de la dosis. Por estas razones, se ha recomendado administrar morfina mediante infusión continua en combinación con anestésicos locales (25-31). La morfina puede considerarse el opioide con el mejor conjunto de características para la administración espinal, pero esto no significa que sea el fármaco ideal en todas las situaciones. En particular, no debe usarse en cirugía ambulatoria o en pacientes con alto riesgo cardiorrespiratorio, y causa efectos secundarios supraespinales retardados, como depresión respiratoria, lo que significa que no se puede recomendar para uso general y los pacientes deben seleccionarse cuidadosamente (34). Todos los opioides intratecales causan algunos de sus efectos analgésicos a través de la selectividad medular, pero los fármacos lipofílicos también pueden alcanzar centros cerebrales más altos mediante la absorción en la sangre y, por lo tanto, causan tanto sedación temprana como depresión respiratoria, dentro de la media hora de comenzar su administración hasta las 2-4 horas de vida media de eliminación (35).
Finalmente, debemos recordar que todos los pacientes que reciben opioides neuroaxiales deben recibir vigilancia y monitorización adecuadas enfocadas a garantizar ventilación, profundidad y frecuencia respiratorias suficientes, así como un nivel apropiado de conciencia, durante un periodo equivalente a la vida media de los fármacos. Por lo tanto, este periodo es de alrededor de 4-6 h para los opioides lipófilos y de 12-48 h para la morfina en el caso de las inyecciones en bolo, y la duración completa del tratamiento cuando es necesaria la infusión continua, para lograr un control analgésico seguro en pacientes con dolor postoperatorio (36).
BIBLIOGRAFÍA